Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hoà tan hoàn toàn hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X (NaOH dư,NaAlO2)
Chú ý thứ tự các phản ứng khi thêm dung dịch HCl vào dung dịch X
HCl + NaOH → NaCl + H2O (1)
NaAlO2+ HCl+ H2O → NaCl + Al(OH)3 (2)
Al(OH)3 + 3HCl → AlCl3 + 3H2O (3)
Khi thêm 0,1 mol HCl thì bắt đầu xuất hiện kết tủa → nNaOH dư = 0,1 mol (xảy ra (1))
Khi thêm 0,2 mol HCl thì xảy ra (1), (2) ( lượng AlO2- trong pt (2)dư )
→ nkết tủa = nH+ phản ứng (2) = 0,2 - 0,1 = 0,1 mol → a = 7,8 gam. Loại B,D
Khi thêm 0,6 mol HCl xảy ra hiện tượng hòa tan kết tủa (xảy ra cả 3 phương trình)
→ 4×nAlO2- = 3nkết tủa + (nH+ -0,1) → nAlO2- = 0,2 mol
Vậy NaAlO2 0,2 mol, NaOH dư 0,1 mol → m= mAl2O3 + mNa2O = 0,1×102 + 0,15×62 = 19,5 gam
Đáp án A

Gọi số mol của Na2O là x, Al2O3 là y mol
Nhận thấy khi thêm 0,1 mol HCl mới bắt đầu tạo kết tủa → Trong dung dịch X chứa NaAlO2 và NaOH dư → nNaOH dư = 0,1 mol
Khi thêm 0,25 mol hoặc 0,65 mol HCl thì lượng kết tủa như nhau → khi thêm 0,25 mol HCl thì lượng HCl hết lượng NaAlO2 còn dư
→ nHCl = nNaOH dư + nAl(OH)3 → 0,25 = 0,1 + nAl(OH)3 → nAl(OH)3 = 0,15 mol
Khi thêm 0,65 mol thì HCl và NaAlO2 đều hết
→ 4nNaAlO2 = (nHCl -nNaOH dư)+ 3nAl(OH)3 → 8y = (0,65-0,1) + 3.0,15 → y = 0,125 mol
Bảo toàn nguyên tố Na → nNa2O = (nNaOH dư + nNaAlO2) :2 = (0,1 + 0,25 ):2 = 0,175mol
→ m= 0,125.102 +0,175.62 = 23,6 gam.
Đáp án B

Đáp án A
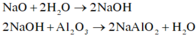
Dung dịch X gồm NaAlO2 và NaOH dư. Khi ta cho thêm 100ml dung dịch HCl vào X thì phản ứng giữa HCl và NaOH xảy ra đầu tiên, sau đó HCl mới phản ứng với NaAlO2
Khi ta cho thêm 0,1 mol HCl bắt đầu có kết tủa xảy ra nên
![]()
Khi ta cho thêm 0,3 mol HCl hoặc 0,7 mol thì đều thu được a gam kết tủa
Áp dụng công thức ta có
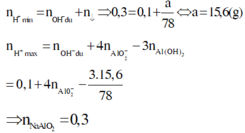
Áp dụng định luật bảo toàn nguyên tố Na và Al
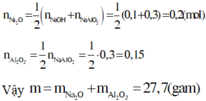

Đáp án A
Khi cho hỗn họp gồm Na2O và A12O3 có phản ứng:
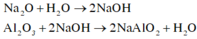
Vì sau một thời gian cho HCl vào dung dịch A mới xuất hiện kết tủa nên A gồm NaA1O2 và NaOH dư
Thứ tự các phản ứng xảy ra:
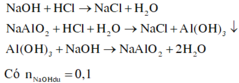
Vì khi cho 200ml hoặc 600ml dung dịch HCl 1M đều thu được a gam kết tủa nên khi cho 200ml dung dịch HCl thì chưa có sự hòa tan kết tủa và khi cho 600ml dung dịch HCl thì đã có sự hòa tan kết tủa.
Do đó:
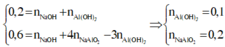
Áp dụng định luật bảo toàn nguyên tố cho Al và Na có
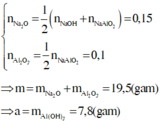

Bắt đầu xuất hiện kết tủa n H C l = n N a O H ( d u ) = 0 , 1 S ố m o l H C l s a u k h i p h ả n ứ n g v ớ i N a O H n H C l ( 1 ) = 0 , 2 - 0 , 1 = 0 , 1 ; n H C l ( 2 ) = 0 , 6 - 0 , 1 = 0 , 5
Do khi cho vào 200ml hoặc 600ml HCl thì đều thu được cùng một lượng kết tủa nên ở TN1 kết tủa chưa tan, ở TN2 kết
tủa tan 1 phần
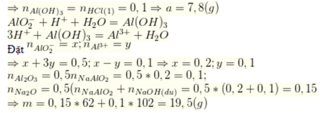

Gọi số mol Na2O và Al2O3 lần lượt là x, y
Nhận thấy khi thêm 0,1 mol HCl vào dung dịch X thì thấy xuất hiện kết tủa
→ Trong dung dịch X chứa NaAlO2 a mol và NaOH :0,1 mol
Bảo toàn nguyên tố → nNa2O = (nNaOH + nNaAlO2):2 = (0,1 + a): 2
nAl2O3 = nNaAlO2 : 2 = a:2
Ta có phương trình : [(0,1 + a): 2 ]×62 + (a:2)×102 = 19,5→ → a= 0,2 mol
CMNaOH = 0,2M, CMNaAlO2 = 0,4M
Đáp án C

Đáp án A
Ta có phương trình phản ứng:
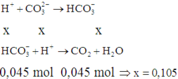
Khi thêm Ba(OH)2 ta có phản ứng:
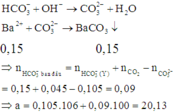


Đáp án C