Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,5}{n}\left(mol\right)\)
Ta có : \(M_M=\dfrac{16,25}{\dfrac{0,5}{n}}=32,5n\)
Chạy nghiệm n
n=1 => M=32,5 (loại)
n=2 => M=65 ( chọn)
n=3 => M=97,5 (loại)
Vậy M là Zn
b) Ta có : \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(lít\right)\)

C2:
PTHH: 2Al+6HCl →2AlCl3 +3H2
a)
Ta có:
\(+n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(+n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Biện luận:
\(\dfrac{0,3}{2}>\dfrac{0,6}{6}\)
⇒Al dư, HCl pư hết.
\(+n_{Al}\)dư =0,3-0,2=0,1(mol
\(+m_{Al}\)dư =0,1.27=2,7(gam)
b)
\(+n_{AlCl_3}=0,2\left(mol\right)\)
⇒\(m_{AlCl_3}=0,2.133,5=26,7\left(gam\right)\)
c) PTHH: H2+CuO→Cu+H2O
\(+n_{CuO}=n_{H_2}=0,3\left(mol\right)\)
\(+m_{CuO}=0,3.80=24\left(gam\right)\)
Chúc bạn học tốt.
\(1.\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2N+2nHCl\rightarrow2NCl_n+nH_2\)
\(\dfrac{0.5}{n}.....0.5...............0.25\)
\(M_N=\dfrac{16.25}{\dfrac{0.5}{n}}=32.5n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow N=65\)
\(Nlà:Zn\)
Không tính được thể tích vì thiếu nồng độ mol nhé.
\(2.\)
\(n_{Al}=\dfrac{8.1}{27}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{21.9}{36.5}=0.6\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.2........0.6..........0.2...........0.3\)
\(m_{Al\left(dư\right)}=\left(0.3-0.2\right)\cdot27=2.7\left(g\right)\)
\(m_{AlCl_3}=0.2\cdot133.5=26.7\left(g\right)\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.....0.3\)
\(m_{CuO}=0.3\cdot80=24\left(g\right)\)

a) Sô mol H2 là: 5,6 : 22,4 = 0,25 (mol)
Gọi hóa trị M là: x
2M + 2xHCl = 2MClx + xH2
0,5/x 0,25 (mol)
Ta có: Mm x 0,5/x = 16,25(g)
=> Mm = 32,5x
Xét x= 1=> Mm= 32,5 (g)
Xét x= 2=> Mm= 65 (g) (Zn)
Xét x= 3=> Mm= 97,5 (g)
Vậy M là kim loại Zn
b)
Zn + 2HCl = ZnCl2 + H2
0,5 0,25 (mol)
Thể tích HCl cần tìm là: 0,5 x 1 : 0,2 = 2,5 (l)

\(1.\\ n_A=\dfrac{16,8}{A}mol\\ n_{H_2}=\dfrac{7,437}{24,79}=0,3mol\\ A+2HCl\rightarrow ACl_2+H_2\\ \Rightarrow\dfrac{16,8}{A}=0,3\\ \Rightarrow A=56g/mol\\ \Rightarrow A.là.Fe\\ \Rightarrow Chọn.A\\ 2.\\ n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=0,1mol\\ V_{H_2}=0,1.24,79=2,479l\\ \Rightarrow Chọn.B\\ 3.\\ Axit:H_2SO_4;HCl\\ \Rightarrow Chọn.B\\ 4.\\ 3,719l\Rightarrow3,7185\\ CTHH:R\\ n_R=\dfrac{3,6}{R}mol\\ n_{H_2}=\dfrac{3,7185}{24,79}=0,15mol\\ R+2HCl\rightarrow RCl_2+H_2\\ \Rightarrow\dfrac{3,6}{R}=0,15\\ \Rightarrow R=24g/mol,Mg\\ \Rightarrow Chọn.B\)

M2O3 + 6 HCl -> 2 MCl3 + 3 H2O
nH2= 0,075(mol)
=>M(M2O3)=1,35/0,075=
Nói chung bài này số nó cứ lì kì á

Gọi công thức hóa học của oxit là RO
→Phương trình hóa học: RO+2HCl→RCl2+H2O
nRO:8,1\(R+16nRO)= nRCl2: 13,6\R+35,5.2
⇔ 8,1.(R+71)=13,6.(R+16)
⇔ 8,1R+575,1=13,6R+217,6
⇔ 8,1R−13,6R=−575,1+217,6
⇔ −5,5R=−357,5
⇔ R=65 (Zn)
→ R là nguyên tố Kẽm (Zn)
công thức hóa học: ZnO
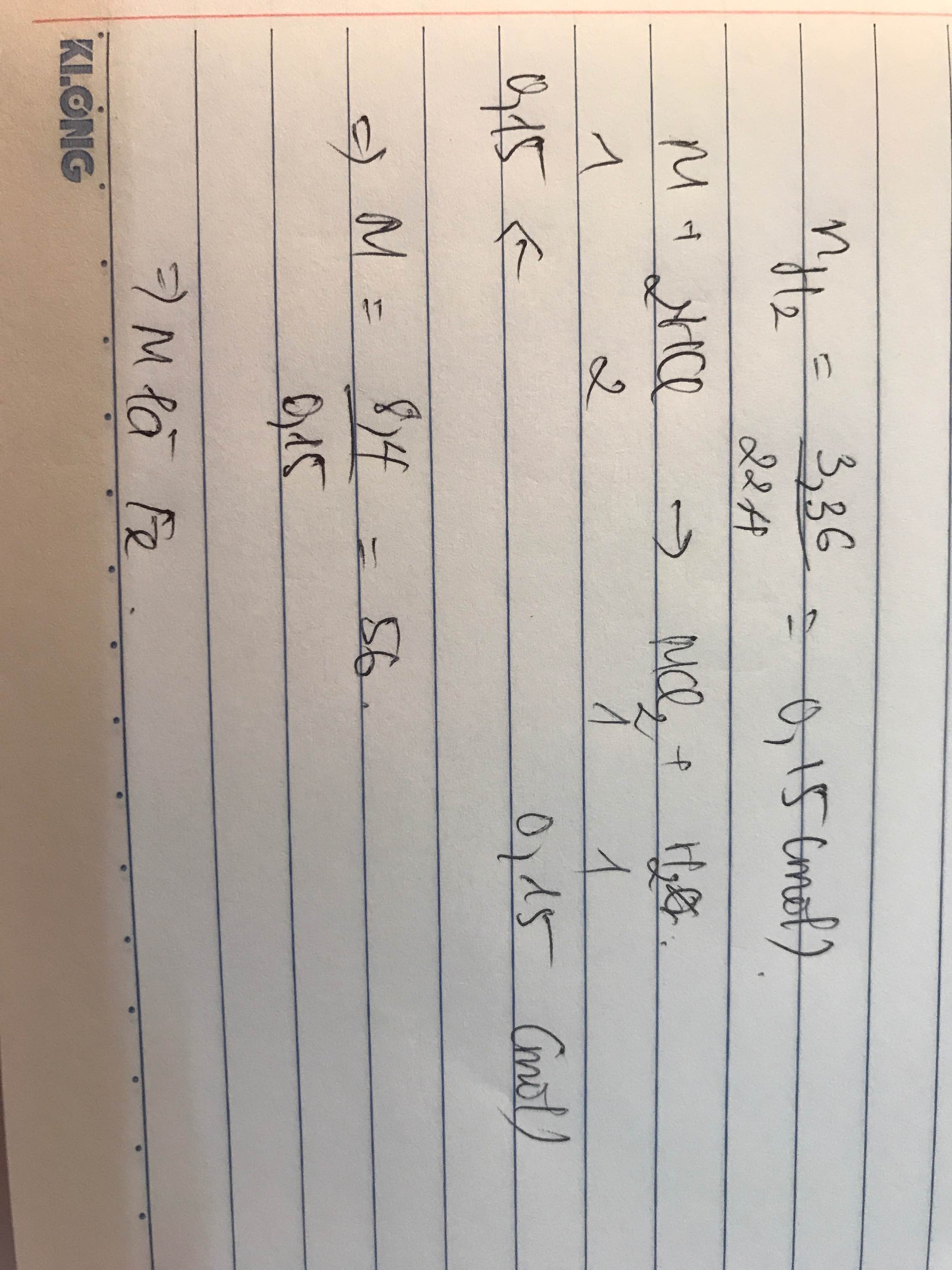
PTHH:\(A+2HCl-->ACl_2+H_2\)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
=> nA=0,25mol
=>\(M_A=\dfrac{16,25}{0,25}=65\left(Zn\right)\)
A + 2HCl \(\rightarrow\)ACl2 + H2
1-----2--------1--------1
0,25-------------------0,25
Theo đề bài , ta có : \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(\Rightarrow n_A=0,25\left(mol\right)\)
\(\Rightarrow M_A=m_A=\dfrac{16,25}{0,25}=65\left(g\right)\)
Vậy A là kim loại kẽm ( Zn )