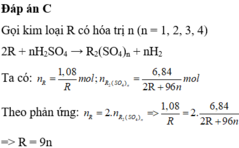Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 Z + n H 2 S O 4 → Z 2 S O 4 n + n H 2
Ta có:
m Z + m S O 4 2 - = m m u o i
m S O 4 2 - = m m u o i - m Z
= 6,84-1,08=5,76g
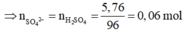
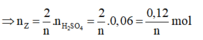
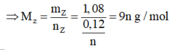
Thử chọn lần lượt n=1, 2, 3 ta được Z là kim loại Al hóa trị III
⇒ Chọn C.

Đặt hóa trị R là \(n(n\in \mathbb{N^*})\)
\(2R+nH_2SO_4\to R_2(SO_4)_n+nH_2\\ \Rightarrow n_R=2n_{R_2(SO_4)_n}\\ \Rightarrow \dfrac{2,16}{M_R}=\dfrac{27,36}{2M_R+96n}\\ \Rightarrow 27,36M_R=4,32M_R+207,36n\\ \Rightarrow M_R=9n\)
Thay \(n=3\Rightarrow M_R=27(g/mol)\)
Vậy R là nhôm (Al)

Zn+ H2SO4→ ZnSO4+ H2↑
(mol) 0,1 0,1 0,1
a)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(lít\right)\)
→mZn=n.M=0,1.65= 6,5(g)
→mCu= 10- 6,5= 3,5(g)
=> \(\%m_{Zn}=\dfrac{6,5}{10}.100\%=65\%\)
\(\%m_{Cu}=100\%-65\%=35\%\)
b) \(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,1}{0,1}=1M\)

a)Thí nghiệm 2 :
$2R + O_2 \xrightarrow{t^o} 2RO$
n O2 = 1,12/22,4 = 0,05(mol)
n R < 2 n O2 = 0,1(mol)
=> R > 3/0,1 = 30(1)
Thí nghiệm 2 : n H2 = 5,6/22,4 = 0,25(mol)
n R = a(mol)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$R + H_2SO_4 \to RSO_4 + H_2$
n Fe = 0,25 - a(mol)
Suy ra :
(0,25 - a).56 + Ra = 11,6
=> R = (56a - 2,4)/a
Mà 0 < a < 0,25
Suy ra : R < 46,6(2)
Từ (1)(2) suy ra : 30 < R < 46,6
Suy ra R là Ca(R = 40)
b) (0,25 -a)56 + 40a = 11,6
=> a = 0,15
%m Ca = 0,15.40/11,6 .100% = 51,72%
%m Fe = 100% -51,72% = 48,28%