Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
Ta có :
n CO2 = 0,1 mol ; n BaCO3 = 11,82 / 197 = 0,06 mol
n K2CO3 = 0,02 mol
khi sục khí CO2 vào dung dịch hỗn hợp gồm K2CO3 và KOH
giả sử chỉ xảy ra phản ứng :
CO2 + 2KOH → K2CO3 + H2O
0,1 0,1
=> n K2CO3(Trong dd ) = 0,1 + 0,02 = 0,12 mol
BaCl2 + K2CO3 →BaCO3 ↓+ KCl
0,12 0,12
Ta thấy : n ↓ = 0,12 ≠ n ↓ đề cho = 0,06 mol
Vậy trong phản ứng CO2 với KOH ngoài muối K2CO3 còn có muối KHCO3.
Áp dụng định luật bảo toàn nguyên tố C ta có :
n C(trong CO2) + n C(trong K2CO3) = n C(trong BaCO3) + n C(trong KHCO3)
=> 0,1 + 0,02 = 0,06 + x (x là số mol BaCO3 )
=> x = 0,06
CO2 + KOH → KHCO3
0,06 0,06 0,06
CO2 + 2KOH → K2CO3 + H2O
0,04 0,08
=> nKOH = 0,14 mol
=> [ KOH ] = 0,14/ 0,1 = 1,4 M

Đáp án A
n C O 2 = 0 , 1 m o l ; n K 2 C O 3 = 0 , 02 m o l
Cho toàn bộ Y tác dụng với BaCl2 dư thu được 0,06 mol kết tủa BaCO3.
Do vậy trong Y chứa 0,06 mol K2CO3.
Bảo toàn C nên Y còn chứa 0,06 mol KHCO3.
Bảo toàn nguyên tố K:
n K O H = 0,06.2 + 0,06 - 0,02.2 = 0,14 => x = 1,4

![]()
Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư được 11,82 gam kết tủa, đó là BaCO3.
Ta có: 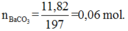
Ta đặt: số mol KOH là: nKOH = 0,1x mol, dd Y chứa KHCO3 = y mol
Nhận thấy ở đây, nếu ta dùng bảo toàn các nguyên tố trước và sau phản ứng thì ta sẽ có các mối liên hệ giữa x và y:
Bảo toàn nguyên tố C ta có:
![]()
Hay 0,1 + 0,02 = 0,06 +y ⇒ y = 0,06 mol
• Bảo toàn nguyên tố K ta được:
![]()
hay 2.0,22+0,1x = 2.0.06+y => x = 1,4
Đáp án B

Đáp án A
Do phần hơi chỉ có H2O nên este có nhóm axit đính trực tiếp vào vòng benzen.
Từ 4 đáp án => là este của phenol ( gốc phenyl).
Như vậy, X sẽ phản ứng với KOH tỉ lệ 1 : 2
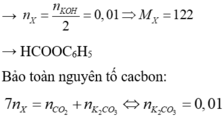
![]()

0,5 \(\left\{{}\begin{matrix}H_2O\\CO_2\end{matrix}\right.\) + C → 0,95 mol \(\left\{{}\begin{matrix}CO\\H_2\\CO_2\end{matrix}\right.\)
Ta có 2nX - nY = nCO2 trong Y
=> nCO2 trong hỗn hợp Y = 0,05 mol
Khi cho Y vào dung dịch Ba(OH)2 thì CO2 sẽ phản ứng với Ba(OH)2
\(\dfrac{nOH^-}{nCO_2}\)= 8 > 2 => Ba(OH)2 dư, phản ứng chỉ tạo BaCO3
nBaCO3 = nCO2 = 0,05 mol => mBaCO3 = 0,05.197 = 9,85 gam.
tks bn nhiu