
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


12.2 cắt quá bạn đăng lại nhé
13
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
a.
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,4->1,2----->0,4-------->0,6
\(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b. \(C\%_{HCl}=\dfrac{1,2.36,5.\left(100+20\right)\%}{200}=26,28\%\)
c. \(n_{HCl.dư}=(\dfrac{200.26,28\%}{100\%}:36,5)-1,2=0,24\left(mol\right)\)
\(C\%_{HCl.dư}=\dfrac{0,24.36,5.100\%}{10,8+200-0,6.2}=4,18\%\)
\(C\%_{AlCl_3}=\dfrac{0,4.133,5.100\%}{10,8+200-0,6.2}=25,48\%\)

\(n_{NaOH}=2.0,3=0,6\left(mol\right)\)
\(PTHH:FeCl_x+xNaOH\rightarrow Fe\left(OH\right)_x+xNaCl\)
pt:__\(56+35,5x\left(g\right)\)__\(x\left(mol\right)\)_________________
pứ:____32,5(g)_____0,6(mol)__________________
Áp dụng định luật tỉ lệ:
\(\frac{56+35,5x}{32,5}=\frac{x}{0,6}\Rightarrow x=3\)
\(\rightarrow CTHH:FeCl_3\)


Câu 21:
\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: x x
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: y 1,5y
Ta có: \(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\%m_{Fe}=\dfrac{0,1.56.100\%}{11}=50,91\%\)
\(\%m_{Al}=100-50,91=49,09\%\)

1
a
Tổng số proton trong \(R_2O\) là 22, ta có:
\(2p_R+p_O=22\\ \Leftrightarrow2p_R+8=22\\ \Rightarrow p_R=\dfrac{22-8}{2}=7\)
=> R là N (Nito)
Xác định vị trí của R (N) trong bản tuần hoàn: thuộc nhóm VA, chu kỳ 2
b
\(\%_{R\left(R_2O\right)}=\%_{N\left(N_2O\right)}=\dfrac{14.2}{14.2+16}.100\%=63,64\%\)
2
Trong phân tử \(AB_2\) có tổng số hạt mang điện bằng 44, ta có:
\(2p_A+4p_B=44\left(1\right)\)
Số hạt mang điện của nguyên tử B nhiều hơn số hạt mang điện của nguyên tử A là 4, ta có:
\(2p_B-2p_A=4\Leftrightarrow-2p_A+2p_B=4\left(2\right)\)
Từ (1), (2) giải được \(\left\{{}\begin{matrix}p_A=6\\p_B=8\end{matrix}\right.\)
=> Nguyên tố A là cacbon và B là oxi.
a
Do cacbon có số hiệu nguyên tử là 6 => nguyên tử C có 6 electron.
=> Số electron phân lớp ngoài của nguyên tử nguyên tố A là 4.
b
Nguyên tử nguyên tố B (O) là phi kim. Vì nguyên tử O có 6 e lớp ngoài cùng.

MgO: Mg có điện hóa trị 2+, O có điện hóa trị 2-
FeF3: Fe có điện hóa trị 3+, F có điện hóa trị 1-
BaCl2: Ba có điện hóa trị 2+, Cl có điện hóa trị 1-
Ca3N2: Ca có điện hóa trị 2+, N có điện hóa trị 3-



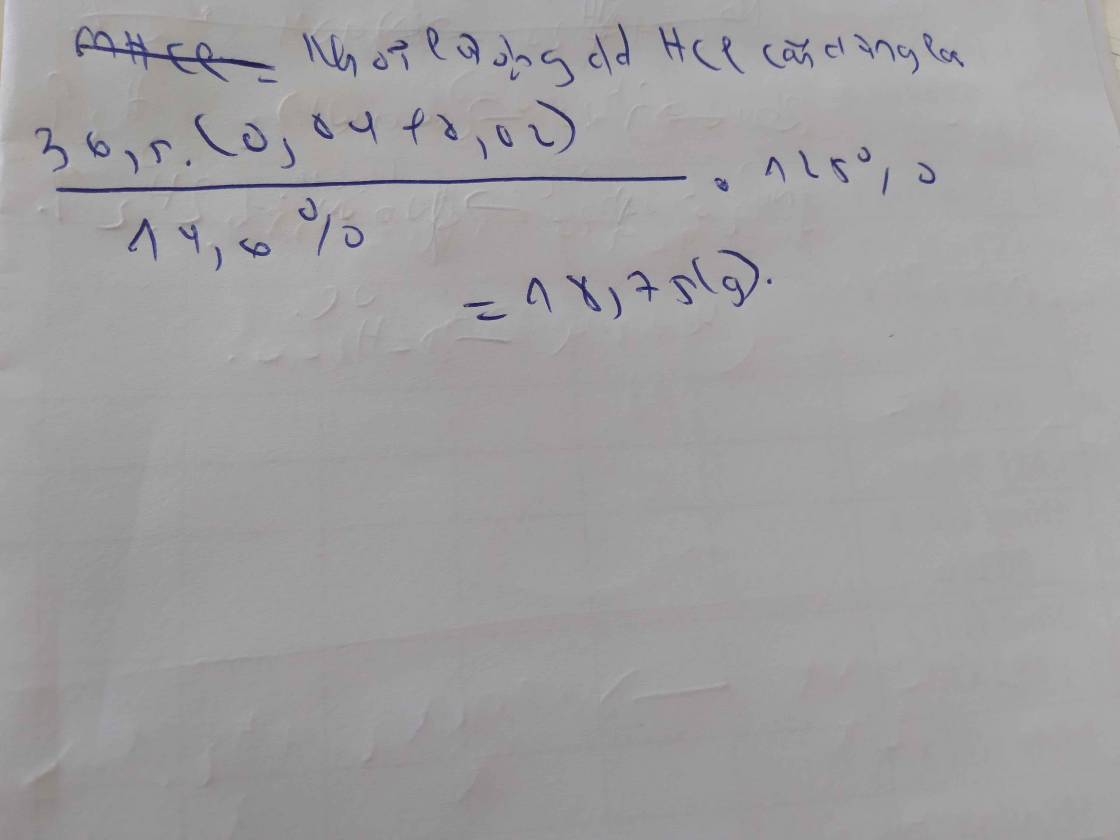





Bài 21:
\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\\ PTHH:MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
0,1---->0,1--------->0,1
a. \(V_{dd.H_2SO_4}=\dfrac{0,1}{1}=0,1\left(l\right)=100\left(ml\right)\)
b. \(CM_{MgSO_4}=\dfrac{0,1}{0,1}=1M\)
Bài 22:
\(n_{CuO}=\dfrac{16}{160}=0,1\left(mol\right)\\ n_{H_2SO_4}=\dfrac{100.19,6\%}{100\%}:98=0,2\left(mol\right)\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
0,1----->0,1------>0,1
Xét \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\Rightarrow n_{H_2SO_4.dư}=0,2-0,1=0,1\left(mol\right)\)
a. Tìm V cái gì vậy?
b. \(C\%_{CuSO_4}=\dfrac{0,1.160.100\%}{16+100}=13,79\%\)
\(C\%_{H_2SO_4}=\dfrac{0,1.98.100\%}{16+100}=8,45\%\)