Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi $n_{Mg} = a ; n_{Al} = b ; n_{Cu} = c$
$\Rightarrow 24a + 27b + 64c = 16,6(1)$
Thí nghiệm 1 :
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$\Rightarrow n_{H_2} = a + 1,5b = \dfrac{11,2}{22,4} = 0,5(2)$
Thí nghiệm 2 : $n_{SO_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
Bảo toàn electron :
$2a + 3b + 2c = 0,6.2(3)$
Từ (1)(2)(3) suy ra a = 0,2 ; b = 0,2 ; c = 0,1
$m_{Mg} = 0,2.24 = 4,8(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
$m_{Cu} = 0,1.64 = 6,4(gam)$

PTPƯ 1:
\(Mg+2HCl->MgCl_2+H_2\)
0,1 0,2 0,1
\(Zn+2HCl->ZnCl_2+H_2\)
0,1 0,2 0,1
Gọi x, y là số mol của H2
Ta có hệ pt:
\(\left\{{}\begin{matrix}24x+65y=8,9\\22,4x+22,4y=4.48\end{matrix}\right.\)
\(=>x=y=0,1\left(mol\right)\)
\(M=\dfrac{n}{V}=\dfrac{0,2}{2}=0,1\left(M\right)\)
Pư 2 làm tg tự nha <3

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
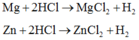
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

a)
\(2C_nH_{2n+1}COOH + 2Na \to 2C_nH_{2n+1}COONa + H_2\\ 2C_mH_{2m+1}OH + 2Na \to 2C_mH_{2m+1}ONa + H_2\\ C_nH_{2n+1}COOH + \dfrac{3n+1}{2}O_2 \xrightarrow{t^o} (n + 1)CO_2 + (n + 1)H_2O\\ C_mH_{2m+1}OH + \dfrac{3m}{2}O_2 \xrightarrow{t^o} m CO_2 + (m + 1)H_2O\\ C_nH_{2n+1}COOH + C_mH_{2m+1}OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons C_nH_{2n+1}COOC_mH_{2m+1} + H_2O\)
b)
Phần 1 :
n X + n Y = 2n H2 = 2.5,6/22,4 = 0,5(mol)
Phần 2 : n CO2 = 57,2/44 = 1,3(mol)
Phần 3 :
n X pư = n Y pư = n H2O = 2,7/18 = 0,15(mol)
- Nếu n X < n Y : Hiệu suất tính theo X
n X = 0,15/75% = 0,2(mol)
=> n Y = 0,5 - n X = 0,5 - 0,2 = 0,3 >n X = 0,2 ( thỏa mãn)
Bảo toàn nguyên tố với C :
(n + 1).n X + m.nY = n CO2
<=>(n + 1).0,2 + 0,3.m = 1,3
<=> 2n + 3m = 11
Với n = 1 ; m = 3 thì thỏa mãn . X là CH3COOH ; Y là C3H7OH
Với n = 4 ; m = 3 thì thỏa mãn . X là C4H9COOH ; Y là CH3OH
- Nếu n X > n Y : Hiệu suất tính theo Y
n Y = 0,15/75% = 0,2(mol)
=> n X = 0,5 - n Y = 0,5 - 0,2 = 0,3 > n Y(thỏa mãn)
n CO2 = (n + 1).n X + m.nY
<=>(n + 1)0,3 + 0,2.m = 1,3
<=> 3n + 2m = 10
Với n = 2 ; m = 2 thì thỏa mãn. X là C2H5COOH ; Y là C2H5OH

Các yếu tố làm tăng tốc độ phản ứng là: nhiệt độ (tăng thì tđpu tăng), áp suất (tăng thì tốc độ
phản ứng có chất khí tăng), S tiếp xúc (tăng thì tốc độ phản ứng tăng), nồng độ (tăng thì tốc độ phản ứng
tăng), xúc tác (luôn tăng)
(a) Có làm tăng tốc độ vì tăng diện tích tiếp xúc của oxi với Cu (ở ngoài không khí còn nhiều khí khác
chiếm chỗ)
(b) Đúng do làm tăng diện tích tiếp xúc giữa Zn và axit
(c) Có làm tăng vì phản ứng có chất khí, tốc độ phản ứng tăng khi tăng áp suất
(d) Không làm thay đổi vì nồng độ của HCl không thay đổi nên tốc độ phản ứng không tăng
Có 3 thay đổi làm tăng tốc độ phản ứng. Đáp án C

a)
2 ancol tách nước tạo ra 2 anken đồng đẳng liên tiếp
=> 2 ancol no, đơn chức, mạch hở, đồng đẳng liên tiếp
Gọi công thức chung 2 ancol là CnH2n+1OH
PTHH
2CnH2n+1OH + 2Na --> 2CnH2n+1ONa + H2
CnH2n+1OH --H2SO4(đ),to--> CnH2n + H2O
CnH2n + \(\dfrac{3n}{2}\)O2 --to--> nCO2 + nH2O
\(n_{C_nH_{2n+1}OH}=\dfrac{p}{14n+18}\left(mol\right)\)
PTHH: 2CnH2n+1OH + 2Na --> 2CnH2n+1ONa + H2
\(\dfrac{p}{14n+18}\)-------------------------->\(\dfrac{p}{28n+36}\)
=> \(x=\dfrac{p}{28n+36}.22,4\left(l\right)\) (1)
Bảo toàn C: \(n_{C_nH_{2n}}=\dfrac{p}{14n+18}\left(mol\right)\)
=> \(V=\dfrac{p}{14n+18}.22,4\left(l\right)\)
=> \(n=\left(\dfrac{22,4p}{V}-18\right):14\)
Thay vào (1): \(x=\dfrac{p}{28.\dfrac{\dfrac{22,4p}{V}-18}{14}+36}.22,4=\dfrac{p}{\dfrac{44,8p}{V}}.22,4=\dfrac{1}{2}V\left(l\right)\)
Bảo toàn C: \(n_{CO_2}=\dfrac{pn}{14n+18}\left(mol\right)\)
=> \(y=\dfrac{p.\dfrac{\dfrac{22,4p}{V}-18}{14}}{14.\dfrac{\dfrac{22,4p}{V}-18}{14}+18}.22,4=\dfrac{22,4p-18V}{14}\left(l\right)\)
b)
\(n=\left(\dfrac{22,4.4,48}{1,568}-18\right):14\approx3,3\)
=> 2 ancol là C3H7OH và C4H9OH
CTCT:
- C3H7OH
(1) \(CH_3-CH_2-CH_2OH\)
(2) \(CH_3-CH\left(OH\right)-CH_3\)
- C4H9OH
(1) \(CH_3-CH_2-CH_2-CH_2OH\)
(2) \(CH_3-CH_2-CH\left(OH\right)-CH_3\)
(3) \(CH_3-CH\left(CH_3\right)-CH_2OH\)
(4) \(CH_3-C\left(CH_3\right)\left(OH\right)-CH_3\)
Gọi \(\left\{{}\begin{matrix}n_{C_3H_7OH}=a\left(mol\right)\\n_{C_4H_9OH}=b\left(mol\right)\end{matrix}\right.\)
=> 60a + 74b = 4,48 (1)
Và a + b = \(\dfrac{1,568}{22,4}=0,07\) (2)
(1)(2) => a = 0,05 (mol); b = 0,02 (mol)
=> \(\left\{{}\begin{matrix}\%m_{C_3H_7OH}=\dfrac{0,05.60}{4,48}.100\%=67\%\\\%m_{C_4H_9OH}=\dfrac{0,02.74}{4,48}.100\%=33\%\end{matrix}\right.\)


Đặt công thức của ancol A là R1(OH)a, công thức của ancol B là R2(OH)b
-Thí nghiệm 1: nOH-= 2.nH2 → 0,015.a + 0,02.b= 2.1,008/22,4= 0,09 mol
-Thí nghiệm 2: nOH-= 2.nH2 → 0,02.a + 0,015.b= 2.0,952/22,4=0,085 mol
Giải hệ trên ta có: a= 2 và b= 3
Vậy A có dạng CnH2n+2O2: 0,015 mol và B có dạng CmH2m+2O3: 0,02 mol
tất cả sản phẩm cháy đi qua bình đựng CaO mới nung, dư thấy khối lượng bình tăng thêm 6,21 gam.
→mCO2+ mH2O= 6,21 gam
→ 44. (0,015n+ 0,02m) + 18. [0,015.(n+1) + 0,02. (m+1)]= 6,21 gam
→ 1,5n + 2m= 9
Biện luận ta thấy n=2 và m=3 thỏa mãn
Vậy A là C2H6O2 hay C2H4(OH)2
B là C3H8O3 hay C3H5(OH)3
tui cần câu b cơ