
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\begin{array}{|c|c|c|} \hline \text{Hợp chất}&SO_2&H_2S&Fe(OH)_3&Na_2SO_4 \\\hline \text{Tên}&\text{Lưu huỳnh đioxit}&\text{Axit sunfuhiđric}&\text{Sắt (III) hiđroxit}&\text{Natri sunfat} \\\hline \text{Oxit}&\text{x} \\\hline \text{Axit}&\text{}&\text{x} \\\hline \text{Bazơ}&\text{}&\text{}&\text{x} \\\hline \text{Muối}&\text{}&\text{}&&\text{x} \\\hline\end{array}\)
cậu ui cậu chụp thành ảnh cho tớ xem dc k ạ, tại nnay tớ k nhìn dc hết ý ạ😢

\(n_{AgNO_3}=0,25\cdot0,2=0,05\left(mol\right);n_{MgCl_2}=0,1\cdot0,3=0,03\left(mol\right)\\ a,PTHH:2AgNO_3+MgCl_2\rightarrow2AgCl\downarrow+Mg\left(NO_3\right)_2\\ \text{Vì }\dfrac{n_{AgNO_3}}{2}< \dfrac{n_{MgCl_2}}{1}\text{ nên sau phản ứng }MgCl_2\text{ dư}\\ \Rightarrow n_{AgCl}=n_{AgNO_3}=0,05\left(mol\right)\\ \Rightarrow a=m_{AgCl}=0,05\cdot143,5=7,175\left(g\right)\\ 2,n_{Mg\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgNO_3}=0,025\left(mol\right)\\ \Rightarrow C_{M_{Mg\left(NO_3\right)_2}}=\dfrac{0,025}{0,2+0,3}=0,05M\)
Đáp án:
CÂU 3:
1)1) PTHH: 2AgNO3+MgCl2→2AgCl↓+Mg(NO3)22AgNO3+MgCl2→2AgCl↓+Mg(NO3)2
nAgNO3=0,2×0,25=0,05(mol)nAgNO3=0,2×0,25=0,05(mol)
nMgCl2=0,3×0,1=0,03(mol)nMgCl2=0,3×0,1=0,03(mol)
Xét nAgNO32nAgNO32 và nMgCl21nMgCl21
→ AgNO3AgNO3 hết, MgCl2MgCl2 dư.
Tính theo số mol AgNO3AgNO3
→ nMgCl2(dư)=0,03−12×0,05=5.10−3(mol)nMgCl2(dư)=0,03−12×0,05=5.10−3(mol)
→ nAgCl=0,05(mol)nAgCl=0,05(mol)
→ nMg(NO3)2=12×0,05=0,025(mol)nMg(NO3)2=12×0,05=0,025(mol)
⇒ a=mAgCl=0,05×143,5=7,175(g)a=mAgCl=0,05×143,5=7,175(g)
b)b) - Dung dịch aa gồm: MgCl2MgCl2 dư và Mg(NO3)2Mg(NO3)2
Xem như thể tích dung dịch sau phản ứng thay đổi không đáng kể.
→ Vdd=0,2+0,3=0,5(l)Vdd=0,2+0,3=0,5(l)
⇒ C(M)MgCl2(dư)=5.10−30,5=0,01(M)C(M)MgCl2(dư)=5.10−30,5=0,01(M)
⇒ C(M)Mg(NO3)2=0,0250,5=0,05(M)

a) H2SO4
b) Ag2SO4 + H2O
c) Na2SO3 + H2O
d) H3PO4
e) ZnNO3 + H2O
f) BaCO3 + H2O
g) CaCl2 + H2O
h) K2O + H2O -> 2KOH
KOH + CO2 -> KHCO3
KHCO3 + KOH -> K2CO3 + H2O
i) Tương tự câu h
k) CaCO3 + H2O
Tự cân bằng

\(\text{Sửa PTHH: }2C_4H_{10}+13O_2\rightarrow^{t^o}8CO_2+10H_2O\\ 2:13:8:10\)

Câu 8:
Gọi x là hóa trị của kim loại M (x: nguyên, dương)
PTHH: 4 M + x O2 -to-> 2 M2Ox
Theo PT: 4M(M)______4M(M)+32x(g)
Theo đề: 5,4_______10,2(g)
Theo PT và đề:
10,2. 4M(M)= 5,4. [4M(M)+32x]
<=> 19,2M(M)= 172,8x
<=>M(M)/x= 172,8/19,2=9/1
=> Chọn x=3 , M(M)=27 là hợp lí thỏa mãn
=> Kim loại M là nhôm (Al=27)

\(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(n_{Fe\left(LT\right)}=2n_{Fe_2O_3}=0,1\left(mol\right)\Rightarrow m_{Fe\left(LT\right)}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow H=\dfrac{4,2}{5,6}.100\%=75\%\)
\(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH :
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,05 0,1
\(m_{Fe\left(LT\right)}=0,1.56=5,6\left(g\right)\)
\(H=\dfrac{4,2}{5,6}.100\%=75\%\)

H2 + CuO \(\xrightarrow[]{t^o}\) Cu + H2O
a) nCuO = 16 : 80 = 0,2mol
Theo pt: nH2 = nCuO = 0,2 mol
=> V H2 = 0,2.22,4 = 4,48 lít
b) Theo pt: nCu = nCuO = 0,2 mol
=> mCu = 0,2 . 64 = 12,8g
nH2O = nCuO = 0,2 mol
=> mH2O = 0,2.18 = 3,6g
c) Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Theo pt: nFe = nH2 = 0,2 mol
=> mFe = 0,2.56 = 11,2g










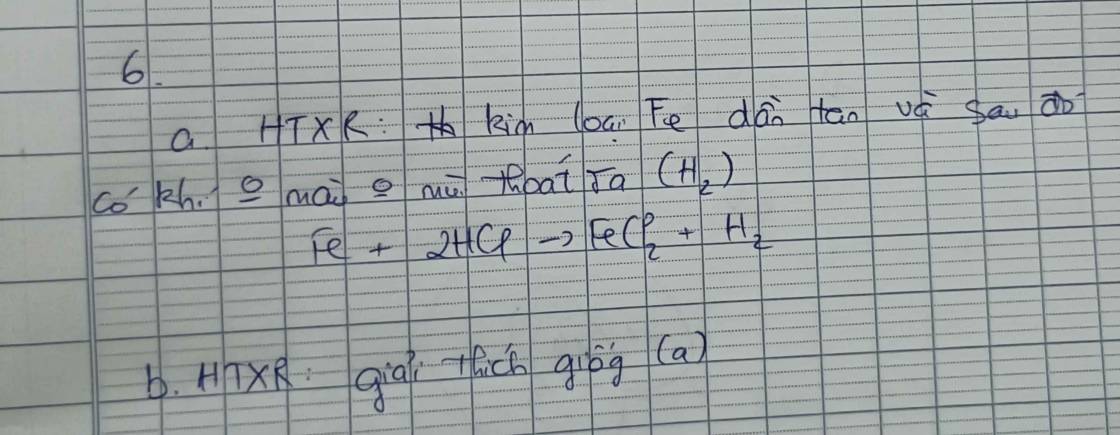



a/\(H_2+FeO\rightarrow^{t^0}Fe+H_2O\) . Phản ứng oxi hóa-khử.
b/\(4Na+O_2\rightarrow^{t^0}2Na_2O\). Phản ứng hóa hợp
c)\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\). Phản ứng thế
d)\(2KClO_3\rightarrow^{t^0}2KCl+3O_2\uparrow\). Phản ứng phân hủy
\(H_2+FeO\rightarrow\left(t^o\right)Fe+H_2O\) : pứ oxi hóa-khử, pứ thế
\(4Na+O_2\rightarrow\left(t^o\right)2Na_2O\) : pứ hóa hợp
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) : pứ thế
\(KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\) : pứ phân hủy