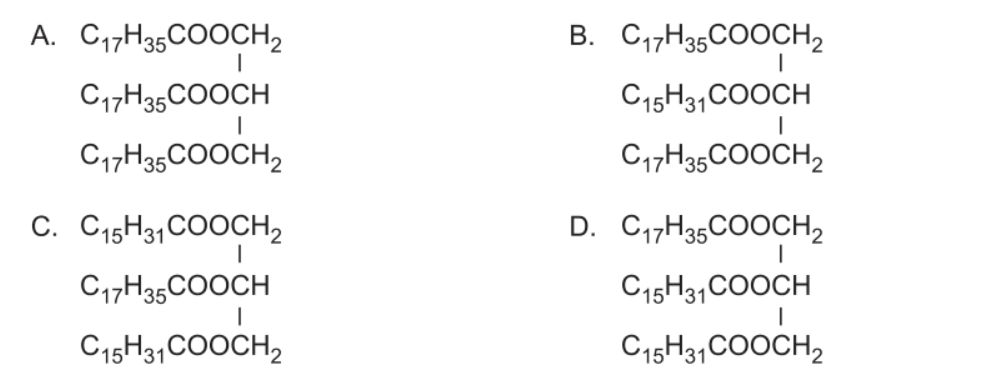Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo mình thì chắc không có, nhưng mình có cái này bạn làm nha!
\(K+H_2O\underrightarrow{t^o}\)
\(Ba+H_2O\underrightarrow{t^o}\)
...

2Ca(OH)2 + 4NO2==> Ca(NO3)2 +Ca(NO2)2 + 2H2O
hiện tượng: khì màu nâu đỏ là NO2 bị hòa tan trong dd. tạo chất rắn màu trắng Ca(NO3)2 và Ca(NO2)2

- Đặt CTDC
- Dựa theo dữ liệu đề cho tìm CTTN
- Biện luận suy ra CTPT

Chọn B
\(\left(C_{52}H_{101}O_6\right)C_3H_5+3H_2O⇌\left(H^+,xt\right)2C_{17}H_{35}COOH+C_{15}H_{31}COOH+C_3H_5\left(OH\right)_3\)

Ah. E xem lại bài giải cho kỹ đi nhé. A đọc đề không kỹ nên không để ý.

61, \(Ag_3PO_4+3HCl-->3AgCl+H_3PO_4\)
62,\(CaCl_2+Na_2CO_3-->CaCO_3+2NaCl\)
63,\(CuSO_4+Fe-->FeSO_4+Cu\)
64, \(2NaCl_{khan}+H_2SO_{4\left(dac\right)}-->Na_2SO_4+2HCl\)
64, \(NaCl+H_2O-->NaOH+HCl\)
65, \(BaCO_3-t^o->BaO+CO_2\uparrow\)
66, \(4KClO_3-t^o->3KClO_4+KCl\)
Còn lại thì ai nhân hậu làm hộ ạ chứ mắt em cà là té hết rồi!