Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi: nFe = nCu = x (mol)
⇒ 56x + 64x = 12 ⇒ x = 0,1 (mol)
Gọi: \(\left\{{}\begin{matrix}n_{NO}=a\left(mol\right)\\n_{NO_2}=b\left(mol\right)\end{matrix}\right.\)
BT e, có: 3nFe + 2nCu = 3nNO + nNO2
⇒ 3a + 2b = 0,5 (1)
Mà: Tỉ khối của X với H2 là 19.
\(\Rightarrow\dfrac{30a+46b}{a+b}=19.2\left(2\right)\)
Từ (1) và (2) ⇒ a = b = 0,1 (mol)
\(\Rightarrow V_{hh}=\left(0,1+0,1\right).22,4=4,48\left(l\right)\)

MX= 19.2=38
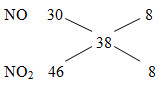
=> nN2=nNO2=x
mFe + mO = moxit
=> mO = moxit- mFe = 7,36-5,6=1,76 gam
=> nO = 0,11 mol
Fe0 →Fe3+ + 3e
0,1 0,3
O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4
0,11 0,22 3x x x x
Bảo toàn e: 0,3 = 0,22+3x+x =0,22+4x =>x= 0,02
=> nkhí = 2x=0,04 mol
=> Vkhí = 0,04.22,4=0,896 lít=896 ml

a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Coi hh X gồm: Fe, Cu và O.
Ta có: nFe = 0,3 (mol)
Quá trình khử oxit: \(H_2+O_{\left(trongoxit\right)}\rightarrow H_2O\)
\(\Rightarrow n_{O\left(trongoxit\right)}=n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
⇒ mCu = 39,2 - mFe - mO (trong oxit) = 39,2 - 0,3.56 - 0,6.16 = 12,8 (g)
BTNT Cu, có: \(n_{CuO}=n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,2.80}{39,2}.100\%\approx40,82\%\\\%m_{Fe_xO_y}\approx100-40,82\approx59,18\%\end{matrix}\right.\)
b, Ta có: \(m_{Fe_xO_y}=39,2-m_{CuO}=23,2\left(g\right)\)
⇒ mO (trong FexOy) = 23,2 - mFe = 6,4 (g) \(\Rightarrow n_O=\dfrac{6,4}{16}=0,4\left(mol\right)\)
⇒ x:y = 0,3:0,4 = 3:4
Vậy: CTHH cần tìm là Fe3O4.

\(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\Rightarrow n_{OH^-}=n_{H^+}=2.0,12=0,24\left(mol\right)\)
Để trung hoà ddX thì cần 0,24 mol H+ có trong ddY.
\(Đặt:n_{H_2SO_4}=a\left(mol\right)\Rightarrow n_{HCl}=2.2a=4a\left(mol\right)\) (Này viết PTHH ra em sẽ hiểu)
\(n_{H^+\left(trongY\right)}=2.n_{H_2SO_4}+n_{HCl}=2a+4a=6a\\ \Leftrightarrow0,24=6a\\ \Leftrightarrow a=0,04\\ \Rightarrow hhY:\left\{{}\begin{matrix}0,04\left(mol\right)H_2SO_4\\0,16\left(mol\right)HCl\end{matrix}\right.\\ \Rightarrow m_{muối}=m_{hh.kloai}+96.0,04+35,5.0,16=8,94+9,52=18,46\left(g\right)\)

câu 7
MgO + 2HCl -> MgCl2 + H2O
x 2x
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
y 6y
CuO + 2HCl -> CuCl2 + H2O
z 2z
A--H2 dư----> MgO + H2O
Fe
Cu
Fe2O3 + 3H2 -> 2Fe + 3H2O
ky
CuO + H2 -> Cu + H2O
kz
nH2O=\(\dfrac{16,2}{18}\)0,09mol
Gọi nMgO=x, nFe2O3=y, nCuO=z (trong 4,8g hh A)
nMgO=kx, nFe2O3=ky, nCuO=kz (trong 0,09mol A)
=> kx+ky+kz =4,8
3ky + kz= 0,09=> 2ky = kx =>\(\left\{{}\begin{matrix}2y=x\\40x+160y+80z=4,8\\2x+6y+2z=\dfrac{5,84}{36,5}=0,16\end{matrix}\right.\)
+ x=0,02
=> mMgO= 0,8g
+y=0,01
=> mFe2O3=1,6g
+ z=0,03
=> mCuO=2,4g
Gọi x,y lần lượt là số mol của Al, Fe
nH2 = 8,9622,4=0,48,9622,4=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt: {27x+56y=111,5x+y=0,4⇔{x=0,2y=0,1{27x+56y=111,5x+y=0,4⇔{x=0,2y=0,1
% mAl = 0,2×2711.100%=49,1%0,2×2711.100%=49,1%
% mFe = 0,1×5611.100%=50,9%0,1×5611.100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
0,4y0,4y<-------0,4
Ta có: 232,2=0,4y(56x+16y)232,2=0,4y(56x+16y)
⇔23,2=22,4xy+6,4⇔23,2=22,4xy+6,4
⇔22,4xy=16,8⇔22,4xy=16,8
⇔22,4x=16,8y⇔22,4x=16,8y
⇔xy=16,822,4=34⇔xy=16,822,4=34
Vậy CTHH của oxit: Fe3O4

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
a____________________a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b___________________b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}24a+56b=10,4\\a+b=\dfrac{6,72}{22,4}=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,2\cdot24=4,8\left(g\right)\\m_{Fe}=5,6\left(g\right)\end{matrix}\right.\)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Pt : Mg + 2HCl → MgCl2 + H2\(|\)
1 2 1 1
a 2a 0,3
Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
b 2b 0,3
Gọi a là số mol của Mg
b là số mol của Fe
Theo đề ta có : mMg + mFe = 10,4 (g)
⇒ nMg . MMg + nFe . MFe = 10,4 g
24a + 56b = 10,4 g (1)
Theo phương trình : 1a + 1b = 0,3 (2)
Từ (1),(2) , ta có hệ phương trình : 24a + 56b = 10,4
1a + 1b = 0,3
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
Khối lượng của magie
mMg = nMg. MMg
= 0,2 .24
= 4,8 (g)
Khối lượng của sắt
mFe = nFe . MFe
= 0,1. 56
= 5,6 (g)
Chúc bạn học tốt
Fe + HNO3 ---> Fe(NO3)3 + NO + H2O (1)
Fe + HNO3 ---> Fe(NO3)3 + X + H2O (2)
Số mol hh khí B = 0,3 mol. Mà tỉ lệ 1:1 nên hai khí có số mol bằng nhau = 0,15 mol.
Áp dụng định luật bảo toàn e ta có: 3.nFe = 0,15.3 + 0,15.(5-n) (với n là số oxy hóa của N trong khí X).
---> 3.0,2 = 0,45 + 0,15.(5-n) ---> n = 4. Vậy X là NO2.