Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.Ta có: nHCl=1.\(\frac{200}{1000}\)=0,2(mol)
Ta có phương trình 2Al + 6HCl -----> 2AlCl3 + 3H2 (1)
Theo phương trình: 2 mol 6 mol 3 mol
Theo đề: x mol 0,2 mol 0,1 mol
=> V\(H_2\)=0,1.22,4=2,24(l)
b. Từ pt (1), ta có:
mAl=x.27=\(\frac{0,2.2}{6}\).27=1,8(g)
c.Từ pt (1), ta có: mHCl=0,2. (1+35,5)=7,3(g)
mdd=\(\frac{200}{1000}.22,4.18=80,64\left(g\right)\)
=>C%=\(\frac{7,3}{80,64}.100\%=9,1\%\)
Ungr hộ nha!

gọi CTC của oxit là R2O3, đặt số mol R2O3 là 0.1(mol)
R2O3+6HCl-->2RCl3+3H2O
0.1 0.6 0.2 0.3 (mol)
C%ddHCl= 0.6x36.5x100/mdd=18.25
==>mddHCl=120(g)
C%ddspu=0.2x(R+35.5x3)x100/[0.1x(2R+48)+120]=23.897
==> R=56 : Fe
C% despite= 0,2x(R+35,5x3) x100/ [0.1x(2R+48)+120]=23.897.LLàm phiền bạn có thể giải thích cho mình rõ hơn chỗ phép tính này đk ko?

a) 2Na + 2H2O -> 2NaOH + H2\(\uparrow\) (1)
nNa = \(\dfrac{2,3}{23}\) = 0,1 (mol)
Theo PT (1) ta có:
+) nNaOH = nNa = 0,1(mol) => mNaOH = 0,1.40 = 4(g)
+) n\(H_2\) = \(\dfrac{1}{2}\)nNa = \(\dfrac{1}{2}\).0,1 = 0,05(mol) => m\(H_2\) = 0,05.2 = 0,1(g)
mdd thu được sau phản ứng là: 2,3 + 197,8 - 0,1 = 200(g)
=> C% = \(\dfrac{4}{200}.100\%\) = 2%
b) CM = \(\dfrac{C\%.10D}{M_{NaOH}}\) = \(\dfrac{2.10.1,08}{40}\) = 0,54(mol/l)

Số mol của đi photpho pentaoxxit
nP2O5 = \(\dfrac{m_{P2O5}}{M_{P2O5}}=\dfrac{28,4}{142}=0,2\left(mol\right)\)
a) Pt : P2O5 + 3H2O → 2H3PO4\(|\)
1 3 2
0,2 0,4
b) Số mol của axit photphoric
nH3PO4 = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit photphoric
mH3PO4 = nH3PO4. MH3PO4
= 0,4 . 98
= 39,2 (g)
Nồng độ phần trăm chất tan của axit photphoric
C0/0H3PO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{39,2.100}{28,4+150}=21,97\)0/0
Chúc bạn học tốt
a) PTHH: P2O5 + 3 H2O -> 2 H3PO4
nP2O5= 28,4/142=0,2(mol)
b) nH3PO4=2.0,2=0,4(mol)
=>mH3PO4=98. 0,4=39,2(g)
mddH3PO4=mP2O5+mH2O=28,4+150=178,4(g)
=>C%ddH3PO4=(39,2/178,4).100=21,973%

a, Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a--->2a------------------>a
2Al + 6HCl ---> 2AlCl3 + 3H2
b---->3b-------------------->1,5b
=> \(\left\{{}\begin{matrix}56a+27b=16,6\\a+1,5b=0,5\end{matrix}\right.\Leftrightarrow a=b=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) \(C\%_{HCl}=\dfrac{\left(0,2.2+0,2.3\right).36,5}{300}.100\%=12,167\%\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
gọi nFe : a , nAl: b (a,b>0) => 56a + 27b = 16,6 (g)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b \(\dfrac{3b}{2}\)
=> \(a+\dfrac{3b}{2}=0,5\)
ta có hệ pt
\(\left\{{}\begin{matrix}56a+27b=16,6\\a+\dfrac{3b}{2}=0,5\end{matrix}\right.\)
=> a= 0,2 , b = 0,2
\(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=16,6-11,2=5,4\left(g\right)\end{matrix}\right.\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 0,4
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6
=> \(m_{HCl}=\left(0,4+0,6\right).36,5=36,5\left(g\right)\)
=> \(C\%=\dfrac{36,5}{200}.100\%=18,25\%\)

a) Pt: SO3 + H2O => H2SO4
b) nSO3 = \(\dfrac{8}{80}=0,1mol\)
Theo pt: nH2SO4 = nSO3 = 0,1 mol
=> CMH2SO4 = 0,1 : 0,25 = 0,4M
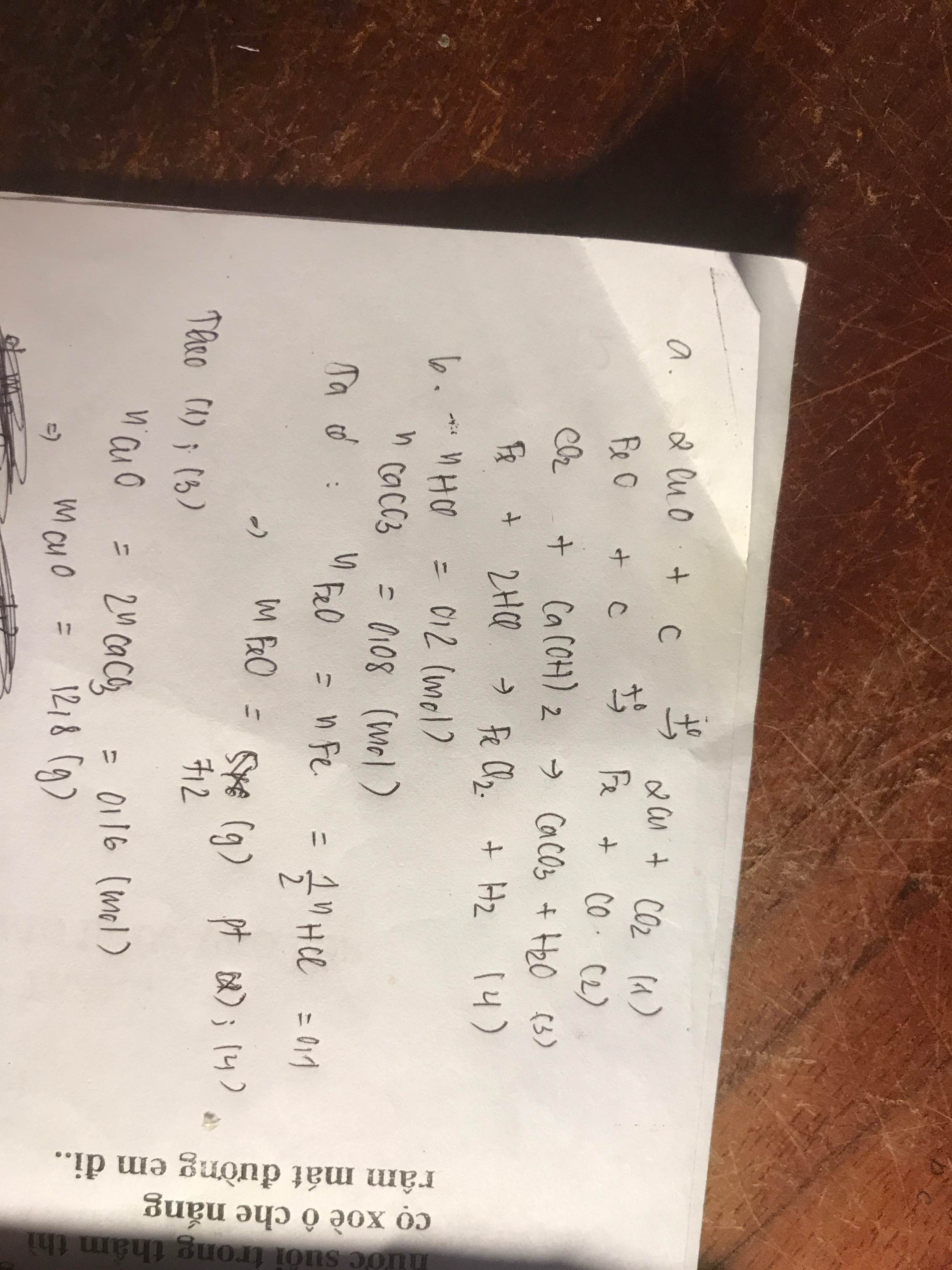
md d =mct + mdm =3,1+46,9=50(gam)
=> \(C\%=\dfrac{m_{ct}.100\%}{m_{dd}}=\dfrac{3,1.100}{50}=6,2\left(\%\right)\)
b) Vì Dnước=1g/mol nên mnước=Vnước
Theo bài ,sự hòa tan chất rắn vào nước thay đổi không đáng kể nên Vd d=Vnước=46,9(lít)
nd d=\(\dfrac{m_{dd}}{M_{dd}}=\dfrac{50}{40}=1,25\left(mol\right)\)
=> \(C_M=\dfrac{n}{V}=\dfrac{1,25}{46,9}\approx0,03\left(M\right)\)
Bạn kiểm tra lại giùm mình đi ,sai chỗ nào thì nhận xét giùm mình nhé
ai giúp mình với ,please