
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 2.
\(n_{Cu}=\dfrac{3,2}{64}=0,05mol\)
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
0,05 0,1 0,05 0,1
\(C_{M_{AgNO_3}}=\dfrac{0,1}{0,2}=0,5M\)
Câu 1:
a.Chất cháy được trong không khí là H² vì Fe tác dụng với HCl tạo H² không màu và cháy được trong không khí
PT: Fe + 2HCl --> FeCl² +H²
b.Chất làm đục nước vôi trong là CaO
PT:CaO + 2HCl --> CaCl² + H²O
c.Dung dịch có màu xanh là Cu
PT: Cu + 2HCl --> CuCl² + H²
d.Dung dịch không màu và nước là CaCO³
PT: CaCO³ + HCl --> CaCl² + CO² + H²O ( vì HCO³ là dung dịch yếu nên không tồn tại lâu vậy đã tách ra thành CO² và H²O)

Câu 3:
$a) \rm n_{Fe} = \dfrac{84}{56} = 1,5 (mol)$
PTHH:
$\rm Fe + 2HCl \rightarrow FeCl_2 + H_2$
Theo PT: $\rm n_{FeCl_2} = n_{Fe} = 1,5 (mol)$
$\rm m_{FeCl_2} = 1,5.127 = 190,5 (g)$
$\rm b)$ Theo PT: $\rm n_{KOH} = 2n_{FeCl_2} = 3 (mol)$
$\rm \Rightarrow C_{M(KOH)} = \dfrac{3}{\dfrac{200}{1000}} = 15M$
Quên PTHH ._.
$\rm FeCl_2 + 2KOH \rightarrow Fe(OH)_2 \downarrow + 2KCl$

Bài 3.\(a.n_{CaCO_3}=\dfrac{7,5}{100}=0,075\left(mol\right)\\ CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\\ b.n_{HCl}=2n_{CaCO_3}=0,15\left(mol\right)\\ \Rightarrow m_{ddHCl}=\dfrac{0,15.36,5}{7,3\%}=75\left(g\right)\\ c.n_{CO_2}=n_{CaCO_3}=0,075\left(mol\right)\\ m_{ddsaupu}=m_{CaCO_3}+m_{ddHCl}-m_{CO_2}=7,5+75-0,075.44=79,2\left(g\right)\\ n_{CaCl_2}=n_{CaCO_3}=0,075\left(mol\right)\\ \Rightarrow C\%_{CaCl_2}=\dfrac{0,075.111}{79,2}.100=10,51\%\)


c, \(2H_2+O_2 \rightarrow2H_2O\)
\(n_{H_2}=\dfrac{33,6}{22,4}=1,5(mol) \Rightarrow n_{O_2}=0,75(mol)\)
\(V_{O_2}=22,4.0,75=16,8(l)\)
\(n_{H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
a. PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PTHH: \(n_{Fe}=n_{H_2}=1,5\left(mol\right)\)
\(\Rightarrow m_{Fe}=56\cdot1,5=84\left(g\right)\)
b. Đổi: \(500ml=0,5l\)
\(CM_{H_2SO_4}=\dfrac{1,5}{0,5}=3M\)
c. \(2H_2+O_2\rightarrow2H_2O\)
Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}\cdot1,5=0,75\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,75\cdot22,4=16,8\left(l\right)\)

1/ Gọi x là hóa trị của nguyên tố cần tìm. Áp dụng quy tắc hóa trị:
a) Fe2O3 : x.2=II.3 => x=III
CuO : x.1=II.1 => x=II
N2O3 : x.2=II.3 => x=III
SO3: x.1=II.3 => x= VI
b) NH3 : x.1=I.3 => x=III
C2H2 : C hóa trị IV, H hóa trị I ( do trong hợp chất hữu cơ, hóa trị của C luôn là IV)
HBr : I.1=x.1 => x=I
H2S: I.2=x.1 => x=II
c)K2S: x.2=II.1 => x=I
MgS : x.1=II.1 => x=II
Cr2S3 : x.2=II.3 => x=III
CS2: x.1=II.2=> x=IV
d) KCl: x.1=I.1=> x=I
HCl: x.1= 1.I => x=I
BaCl2 : x.1=I.2 => x=II
AlCl3 : x.1=I.3 => x=III
e) ZnCO3 : x.2=II.1 => x=II
BaSO4 : x.1=II.1 => x=II
Li2CO3 : x.2=II.1 => x=I
Cr2(SO4)3 : x.2=II.3 => x=III
f) NaOH : x.1=1.I => x=I
Zn(OH)2 : x.1=I.2 => x=II
AgNO3 : x.1=I.1 => x=I
Al(NO3)3 : x.1=I.3 => x=III
2.a) HCl : H(I), Cl(I)
H2S: H(I), S(II)
NH3 : N(III), H(I)
H2O : H(I), O(II)
CH4: C(IV), H(I)
b) NO: N(II), O(II)
N2O: N(I), O(II)
NO2: N(IV), O(II)
N2O5: N(V), O(II)
HNO3 : H(I), NO3 (I)
Ca(NO3)2 : Ca(II), NO3 (I)
NaNO3: Na(I), NO3 (I)
Al(NO3)3: Al (III),NO3 (I)
c) CaO: Ca(II), O(II)
K2O: K(I), O(II)
MgO : Mg(II), O(II)
Na2O: Na(I), O(II)
Al2O3: Al(III), O(II)
d) SO2: S(IV) ,O(II)
SO3: S(VI), O(II)
Na2S: Na(I), S(II)
FeS: Fe(II), S(II)
Al2S3: Al(III), S(II)
H2SO4: H(I), SO4(II)
CuSO4: Cu(II), SO4(II)
Al2(SO4)3: Al(III), SO4(II)
e) P2O5: P(V), O(II)
H3PO4: H(I), PO4(III)
Na3PO4: Na(I), PO4(III)
Ca3(PO4)2: Ca(II), PO4(III)

a)
$CH_3COOH + KOH \to CH_3COOK + H_2O$
n CH3COOH = n KOH = 0,1(mol)
$CH_3COOH + 2O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O$
$C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
$CO_2 +C a(OH)_2 \to CaCO_3 + H_2O$
2n C2H5OH + 2n CH3COOH = n CO2 = n CaCO3 = 60/100 = 0,6(mol)
=> n C2H5OH = (0,6 - 0,1.2)/2 = 0,2(mol)
=> n O2 = 2n CH3COOH + 3n C2H5OH = 0,1.2 + 0,2.3 = 0,8(mol)
=> V O2 = 0,8.22,4 = 17,92 lít
b) m = 0,1.60 + 0,2.46 = 15,2 gam
%m CH3COOH = 0,1.60/15,2 .100% = 39,47%
%m C2H5OH = 100%- 39,47% = 60,53%

nNa2SO4= 9,94/142=0,07(mol);
mBa(OH)2= 20,52(g) -> nBa(OH)2=0,12(mol)
PTHH: Na2SO4 + Ba(OH)2 -> BaSO4 + 2 NaOH
Ta cps: 0,07/1 < 0,12/1
=> Ba(OH)2 dư, Na2SO4 hết, tính theo nNa2SO4.
-> nBaSO4=nNa2SO4= 0,07(mol)
=> m(kết tủa)=mBaSO4=0,07.233=16,31(g)
=>m=16,31(g)
b) Dung dịch A thu được bao gồm NaOH và Ba(OH)2 dư.
nNaOH=2.0,07=0,14(mol) => mNaOH= 0,14.40=5,6(g)
nBa(OH)2 (dư)=0,12-0,07=0,05(mol)
=> mBa(OH)2 (dư)= 0,05.171=8,55(g)
=> mddA=Na2SO4 + mddBa(OH)2 - mBaSO4 = 9,94+ 100 - 16,31= 93,63(g)
=> C%ddBa(OH)2 (dư)= (8,55/93,63).100=9,132%
C%ddNaOH= (5,6/93,63).100=5,981%


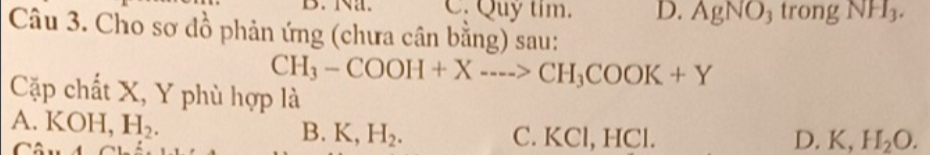


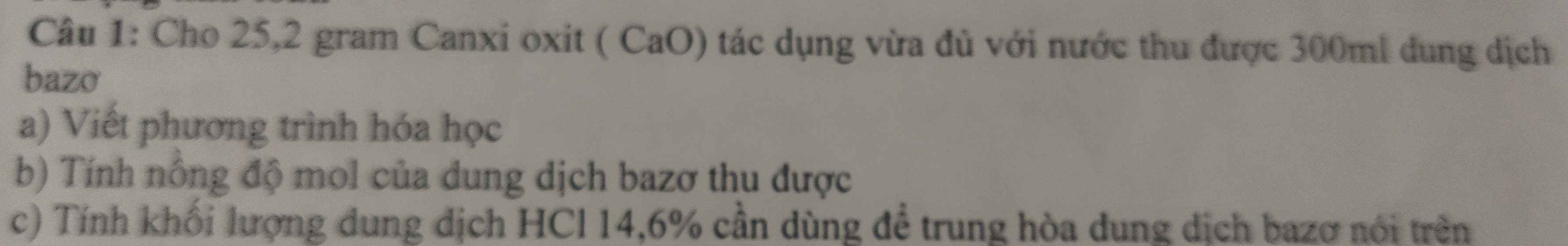
 giúp mình câu c với ạ, 2 câu trên mình biết làm rồi
giúp mình câu c với ạ, 2 câu trên mình biết làm rồi


Ống nghiệm 1 là Al do chỉ có kim loại Al trong 3 kim loại mới tác dụng với NaOH,có khí thoát ra
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Thay NaOH bằng H2SO4 loãng thấy ống nghiệm 1,3 thoát ra khí
=> Ống nghiệm 3 là Fe, do Fe tác dụng với H2SO4
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
=> Ống nghiệm thứ 2 còn lại là Ag