
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{HCl}=0,2.0,75=0,15mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,15 0,075 ( mol )
\(m_{ZnCl_2}=0,075.136=10,2g\)
\(n_{HCl}=0,75.0,2=0,15\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\\
\)
0,15 0,075
\(m_{ZnCl_2}=0,075.136=10,2\left(g\right)\)


11. \(xFe_2O_3+\left(3x-2y\right)H_2\underrightarrow{t^o}2Fe_xO_y+\left(3x-2y\right)H_2O\)
14. \(Fe_2O_3+6HNO_3\rightarrow2Fe\left(NO_3\right)_3+3H_2O\)
17. \(2KMnO_4+8HCl\rightarrow2KCl+2MnCl_2+Cl_2+4H_2O\)
26. \(8Al+30HNO_3\rightarrow8Al\left(NO_3\right)_3+3NH_4NO_3+9H_2O\)

câu 1:
gọi hóa trị của các nguyên tố cần tìm là \(x\)
\(\rightarrow H^I_1Br^x_1\rightarrow I.1=x.1\rightarrow x=I\)
vậy \(Br\) hóa trị \(I\)
\(\rightarrow H_2^IS_1^x\rightarrow I.2=x.1\rightarrow x=II\)
vậy \(S\) hóa trị \(II\)
\(\rightarrow Na_2^xO^{II}_1\rightarrow x.2=II.1\rightarrow x=I\)
vậy \(Na\) hóa trị \(I\)
các ý còn lại làm giống nhé!
câu 2:
gọi hóa trị của \(Fe\) và \(Al\) trong các hợp chất là \(x\)
\(\rightarrow Fe^x_1O^{II}_1\rightarrow x.1=II.1\rightarrow x=II\)
vậy \(Fe\) hóa trị \(II\)
\(\rightarrow Al_2^x\left(SO_4\right)_3^{II}\rightarrow x.2=II.3\rightarrow x=III\)
vậy \(Al\) hóa trị \(III\)
mấy ý còn lại làm tương tự

| Công thức | Phân loại | Gọi tên | |
| Na(I) | \(Na_2^IO^{II}\) | Oxit bazo | Natri oxit |
| K(I) | \(K_2^IO^{II}\) | Oxit bazo | Kali oxit |
| N(I) | \(N_2^IO^{II}\) | Oxit axit | Đinito oxit |
Mg(II)
| \(Mg^{II}O^{II}\) | Oxit bazo | Magie oxit |
| Zn(II) | \(Zn^{II}O^{II}\) | Oxit bazo | Kẽm oxit |
| N(V) | \(N^V_2O^{II}_5\) | Oxit axit | Đinito pentaoxit |
| N(II) | \(N^{II}O^{II}\) | Oxit axit | Nito oxit |
| N(IV) | \(N^{IV}O^{II}_2\) | Oxit axit | Nito đioxit |
Vì em học lớp 8 mới có 2 loại oxit axit, oxit bazo nên anh xếp như này nhé! Sau này lớp 9 em sẽ thấy ZnO là oxit lưỡng tính, NO là oxit trung tính,..
K (I) :
ct : K2O ; phân loại : oxit axit ; gọi tên : Kali oxit
N(I) : N2O : phân loại : oxit trung tính ; gọi tên : dinitơ monoxide
N ( II) NO ; phân loại : oxit trung tính ; gọi tên ; nitơ monoxide
Mg(II) : MgO ; phân loại : oxit bazơ ; gọi tên : Magie oxide
Zn(II) ; ZnO ; phân loại ; oxit lưỡng tính ; gọi tên Kẽm oxide
N (IV) NO2 : phân loại : oxit axit ; gọi tên : Đioxide nitơ

1. a. \(n_{Cu}=\dfrac{6.4}{64}=0,1\left(mol\right)\)
PTHH : CuO + H2 ---to---> Cu + H2O
0,1 0,1
\(m_{Cu}=0,1.64=6,4\left(g\right)\)

Ta có: \(\left\{{}\begin{matrix}n_{CO}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\\overline{M}_{khí}=20\cdot2=40\end{matrix}\right.\)
+) Trường hợp 1: hh X gồm CO2 và O2 dư
Theo sơ đồ đường chéo: \(\dfrac{n_{CO_2}}{n_{O_2\left(dư\right)}}=\dfrac{40-32}{44-40}=2\)
PTHH: \(CO+\dfrac{1}{2}O_2\xrightarrow[]{t^o}CO_2\)
Theo PTHH: \(n_{CO_2}=n_{CO}=0,3\left(mol\right)\) \(\Rightarrow n_{O_2\left(dư\right)}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO_2}=\dfrac{0,3}{0,3+0,15}\cdot100\%\approx66,67\%\\\%V_{O_2\left(dư\right)}=33,33\%\\\%m_{CO_2}=\dfrac{0,3\cdot44}{0,3\cdot44+0,15\cdot32}\approx73,33\%\\\%m_{O_2\left(dư\right)}=26,67\%\end{matrix}\right.\)
+) Trường hợp 2: hh X gồm CO2 và CO dư
Gọi số mol p/ứ của CO là x
Theo sơ đồ đường chéo: \(\dfrac{n_{CO_2}}{n_{CO\left(dư\right)}}=\dfrac{40-28}{44-40}=3\)
PTHH: \(CO+\dfrac{1}{2}O_2\xrightarrow[]{t^o}CO_2\)
BĐ: 0,3
P/ứ: x____\(\dfrac{1}{2}\)x_____x
Dư: (0,3-x)__________x
Vì \(n_{CO_2}=3n_{CO\left(dư\right)}\) (dựa vào tỉ lệ ở trên)
\(\Rightarrow x=3\left(0,3-x\right)\) \(\Rightarrow x=0,225\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,225\left(mol\right)\\n_{CO\left(dư\right)}=0,075\left(mol\right)\end{matrix}\right.\)
Tới đây thì tương tự như trường hợp 1


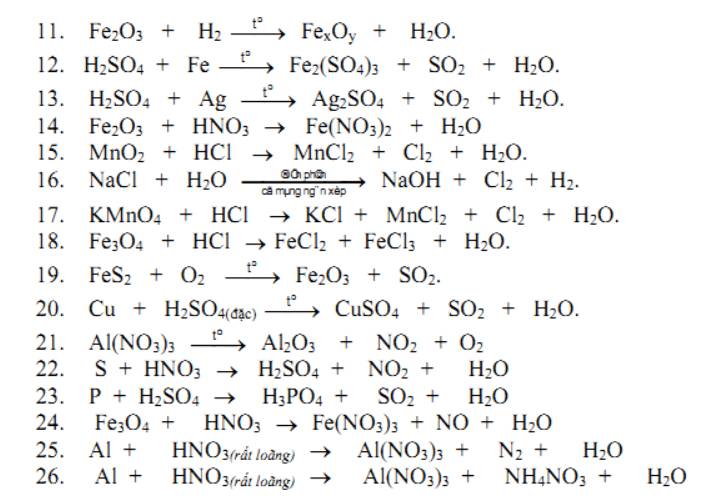

 Mn ơi, giải hộ mik câu này với! Tối nay mik phải nộp rồi ạ! Cảm ơn mn nhiều lắm!
Mn ơi, giải hộ mik câu này với! Tối nay mik phải nộp rồi ạ! Cảm ơn mn nhiều lắm!




Câu 2:
\(1,4P+5O_2\xrightarrow{t^o}2P_2O_5\\ 2,2Fe+3Cl_2\xrightarrow{t^o}2FeCl_3\\ 3Al_2O_3+3H_2SO_4\to Al_2(SO_4)_3+3H_2O\\ 4,2KMnO_4\xrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\\ 5,2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\\ 6,Al_2O_3+3H_2SO_4\to Al_2(SO_4)_3+3H_2O\\ 7,4Na+O_2\to 2Na_2O\\ 8,C_nH_{2n-2}+\dfrac{3n-1}{2}O_2\xrightarrow{t^o}nCO_2\uparrow+(n-1)H_2O\)