Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuO}=\frac{m}{M}=\frac{8}{80}=0,1mol\)
PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
0,1 0,2 0,1 0,1 mol
a. \(m_{CuCl_2}=n.M=0,1.135=13,5g\)
b. \(200ml=0,2l\)
\(C_{M_{HCl}}=\frac{n}{V}=\frac{0,2}{0,2}=1M\)

PTHH H 2 S O 4 + N a 2 S O 3 → N a 2 S O 4 + S O 2 ↑ + H 2 O
S O 2 : lưu huỳnh đioxit.
⇒ Chọn C.

Đáp án C
N a 2 S O 3 + H 2 S O 4 → N a 2 S O 4 + S O 2 ↑ + H 2 O

\(n_{H_2SO_4}=\dfrac{98.5\%}{98}=0,05\left(mol\right)\\ PTHH:CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4}=n_{CuO}=n_{H_2SO_4}=0,05\left(mol\right)\\ a,m_{CuO}=0,05.80=4\left(g\right)\\ b,m_{CuSO_4}=0,05.160=8\left(g\right)\\ m_{ddCuSO_4}=98+4=102\left(g\right)\\ C\%_{ddCuSO_4}=\dfrac{8}{102}.100\approx7,843\%\)

Tính chất: Hidroxit tác dụng với axit tạo thành muối và nước
\(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
Theo PTHH :
$n_{CuO} = n_{H_2SO_4} = \dfrac{98.40\%}{98} = 0,4(mol)$
$m = 0,4.80 = 32(gam)$
b)
$m_{dd\ sau\ pư} = 32 + 98 = 130(gam)$
$n_{CuSO_4} = n_{H_2SO_4} = 0,4(mol)$
$C\%_{CuSO_4} = \dfrac{0,4.160}{130}.100\% = 49,23\%$
a) \(m_{H_2SO_4}=98.40\%=39,2\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: CuO + H2SO4 → CuSO4 + H2O
Mol: 0,4 0,4 0,4
\(m_{CuO}=0,4.80=32\left(g\right)\)
b) mdd sau pứ = 32 + 98 = 130 (g)
\(C\%_{ddCuSO_4}=\dfrac{0,4.160.100\%}{130}=49,23\%\)
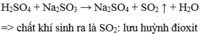
Xanh lam
\(PTHH:H_2SO_4+Cu\left(OH\right)_2--->CuSO_4+2H_2O\)
Vậy dung dịch sau phản ứng là CuSO4, mà muối của Cu luôn có màu xanh làm, vậy dung dịch sau phản ứng có màu xanh làm.