
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Axit H3PO4 là axit 3 nấc nên phản ứng với NaOH có thể xảy ra 3 phương trình như sau
H3PO4 +3NaOH =>Na3PO4 +3H2O
H3PO4 +2NaOH =>Na2HPO4 +2H2O
H3PO4+NaOH =>NaH2PO4 +H2O
Xét tỉ lệ mol NaOH/mol H3PO4=T
Nếu T=1=>chỉ tạo muối NaH2PO4 Tương tự với T=2;T=3
ở đây đbài của bạn là 0,625/0,4=1,5625 T nằm giữa khoảng 1 và 2 nên sẽ ra 2 muối NaH2PO4 và Na2HPO4
Pt đó không sai nhưng nếu bạn chưa học về dung dịch điện li thì hãy viết 2NaOH+H3PO4 đặt ẩn giải hpt cho đỡ rối

nFe2O3= \(\frac{1,6}{160}\) =0,01 (mol)
n HNO3= 1 . 0,2=0,2 (mol)
Fe2O3 + 6HNO3 --------> 2Fe(NO3)3 + 3H2O
ban đầu 0,01 0,2 }
pư 0,01 ------> 0,06 ------> 0,02 ----> 0,03 } (mol)
sau pư 0 0,14 0,02 0,03 }
CM(Fe(NO3)3)= \(\frac{0,02}{0,2}\)=0,1(M)
CM(HNO3) = \(\frac{0,14}{0,2}\)= 0,7(M)
2) n H2SO4= 2 . 0,1 = 0,2(mol)
MgO + H2SO4 -------> MgSO4 + H2O (1)
CuO + H2SO4 --------> CuSO4 + H2O (2)
Gọi n MgO= a ; n CuO=b trong 12 g hh
==> 40a + 80b = 12 (l)
Theo pt (1)(2) tổng n H2SO4 = a+b= 0,2 (ll)
Từ (I)(ll) ==> a=b=0,1
m MgO = 0,1 . 40=4(g)
m Cuo = 12 - 4 = 8(g)
%m MgO = \(\frac{4}{12}\). 100%=33,33%
%mCuO=66.67%

Bài 1
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ b,n_{Mg}=0,1(mol)\Rightarrow m_{Mg}=0,1.24=2,4(g)\\ \Rightarrow m_{MgO}=4,4-2,4=2(g)\\ c,n_{MgO}=\dfrac{2}{40}=0,05(mol)\\ \Rightarrow \Sigma n_{HCl}=0,1.2+0,05.2=0,3(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{0,3.36,5}{7,3\%}=150(g)\)
Bài 2:
\(n_{Fe}=\dfrac{11,2}{56}=0,2(mol)\\ a,Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{H_2}=0,2(mol)\Rightarrow V_{H_2}=0,2.22,4=4,48(l)\\ b,n_{H_2SO_4}=0,2(mol)\\ \Rightarrow C\%_{H_2SO_4}=\dfrac{0,2.98}{200}.100\%=9,8\%\\ c,n_{FeSO_4}=0,2(mol)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{0,2.152}{11,2+200-0,2.2}.100\%=14,42\%\)
BT nhận biết:
Trích mẫu thử từng chất trong từng trường hợp
\(a,\) Dùng quỳ tím:
- Hóa đỏ: \(HCl,H_2SO_4\)
- Hóa xanh: \(NaOH\)
- Ko đổi màu: \(Na_2SO_4\)
Cho \(BaCl_2\) vào nhóm quỳ hóa đỏ, tạo KT trắng là \(H_2SO_4\), ko hiện tượng là \(HCl\)
\(H_2SO_4+BaCl_2\to BaSO_4\downarrow+2HCl\)
\(b,\) Dùng dd \(BaCl_2\), tạo KT trắng: \(Na_2CO_3\)
Cho \(AgNO_3\) vào các mẫu thử còn lại, tạo KT trắng: \(NaCl\)
Còn lại là \(NaNO_3\)
\(Na_2CO_3+BaCl_2\to BaCO_3\downarrow+2NaCl\\ AgNO_3+NaCl\to AgCl\downarrow+NaNO_3\)
\(c,\) Dùng quỳ tím, quỳ hóa xanh: \(NaOH\)
Cho các mẫu thử còn lại vào dd \(BaCl_2\)
- Tạo KT trắng: \(Na_2SO_4\)
- Ko ht: \(NaCl\)
\(BaCl_2+Na_2SO_4\to 2NaCl+BaSO_4\downarrow\)


Bài 11:
\(PTHH:2A+Cl_2\rightarrow2ACl\\TheoĐLBTKL:\\ m_A+m_{Cl_2}=m_{ACl}\\ \Leftrightarrow 9,2+m_{Cl_2}=23,4\\ \Rightarrow m_{Cl_2}=23,4-9,2=14,2\left(g\right)\\ n_{Cl_2}=\dfrac{14,2}{71}=0,2\left(mol\right)\\ n_A=2.0,2=0,4\left(mol\right)\\ M_A=\dfrac{9,2}{0,4}=23\left(\dfrac{g}{mol}\right)\\ \Rightarrow A\left(I\right):Natri\left(Na=23\right)\)

Khi chất phản ứng chính là phân tử phản ứng vì hạt hợp thành hầu hết từ các chất là phân tử mà phân tử thể hiện đầy đủ tính chất hóa học của chất.

PTHH: 2NaOH + H2SO4 ---> Na2SO4 + 2H2O
Ta có: \(C_{\%_{NaOH}}=\dfrac{m_{NaOH}}{100}.100\%=20\%\)
=> mNaOH = 20(g)
=> nNaOH = \(\dfrac{20}{40}=0,5\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=\dfrac{1}{2}.n_{NaOH}=\dfrac{1}{2}.0,5=0,25\left(mol\right)\)
=> \(m_{H_2SO_4}=98.0,25=24,5\left(g\right)\)

13. D (1s22s22p63s23p5)
14. A (Nhận thêm để đạt cấu hình bền vững)
15. B (Nhóm halogen có 7e lớp ngoài cùng)




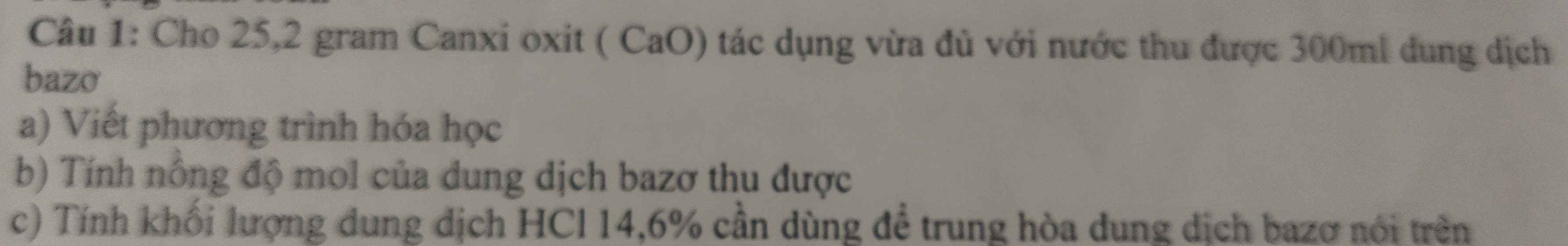


 Giải giúp
Giải giúp
\(\Leftrightarrow\left\{{}\begin{matrix}46a+46b+14b=20,5\\a+b=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}46\left(a+b\right)+14b=20,5\\a+b=0,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}46.0,4+14b=20,5\\a+b=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}14b=2,1\\a+b=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}b=0,15\\a+0,15=0,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}b=0,15\\a=0,25\end{matrix}\right.\)