Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 6 :
200ml = 0,2l
300ml = 0,3l
\(n_{HCl}=0,15.0,2=0,03\left(mol\right)\)
\(n_{NaOH}=0,12.0,3=0,036\left(mol\right)\)
Pt : \(HCl+NaOH\rightarrow NaCl+H_2O|\)
1 1 1 1
0,03 0,036
Lập tỉ số só sánh : \(\dfrac{0,03}{1}< \dfrac{0,036}{1}\)
⇒ HCl phản ứng hết , NaOH dư
⇒ Tính toán dựa vào số mol của HCl
Khi thêm phenolplatein vào dung dịch NaOH dư thì dung dịch sẽ có màu đỏ
⇒ Chọn câu : D
Chúc bạn học tốt

(NH4)2CO3 + Ba(OH)2 -> BaCO3 + 2 NH3 + 2 H2O
nBa(OH)2= 34,2/171=0,2(mol)
n(NH4)2CO3=0,1(mol)
Ta có: 0,2/1 > 0,1/1
=> Ba(OH)2 dư, (NH4)2CO3 hết => Tính theo n(NH4)2CO3
=> nBaCO3=n(NH4)2CO3= 0,1(mol)
=>m(kết tủa)= mBaCO3=0,1. 197=19,7(g) => m=19,7(g)
nCO2= 2. n(NH4)2CO3=2.0,1=0,2(mol)
=>V(CO2,đktc)= 0,2.22,4=4,48(l) => V=4,48(l)
\(n_{Ba\left(OH\right)_2}=\dfrac{34,2}{171}=0,2\left(mol\right)\)
(NH4)2CO3 + Ba(OH)2→ BaCO3↓ + 2NH3+ 2H2O
0,1 mol 0,2 mol 0,1 mol 0,2 mol
mBaCO3= 0,1.197= 19,7 gam
\(V_{NH_3}=0,2.22,4=4,48\left(l\right)\)

PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\cdot1=0,2\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH còn dư
\(\Rightarrow\) Dung dịch sau p/ứ có môi trường bazơ
\(\Rightarrow n_{NaCl}=0,1\left(mol\right)=n_{NaOH\left(dư\right)}\) \(\Rightarrow C_{M_{NaCl}}=\dfrac{0,1}{0,2+0,1}\approx0,33\left(M\right)=C_{M_{NaOH\left(dư\right)}}\)

Đáp án A
Gọi x là số mol Ca(OH)2 cần dùng
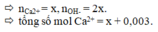
OH - + HCO3- → CO32- + H2O
2x 2x
Ca2+ + CO32-→ CaCO3
Để loại bỏ hết ion Ca2+ thì nCa2+ = nCO3(2-)
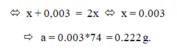

a) ta có : \(\dfrac{NaOH}{\dfrac{0,2}{\dfrac{0,2}{0}}}\dfrac{+}{ }\dfrac{H_2SO_4}{\dfrac{0,12}{\dfrac{0,1}{0,02}}}\dfrac{\rightarrow}{ }\dfrac{Na_2SO_4}{ }\dfrac{+}{ }\dfrac{2H_2O}{ }\)
\(\Rightarrow\dfrac{H_2SO_4}{0,02}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,04}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\) \(\Rightarrow\left[H^+\right]=\dfrac{0,04}{0,4}=0,1\)
ta có : \(pH_B=-\log_{10}0,1=1\)
vậy \(pH\) của dung dịch \(B\) là \(1\)
b) ta có : \(\dfrac{NaOH}{0,2}\dfrac{\rightarrow}{ }\dfrac{Na^+}{ }\dfrac{+}{ }\dfrac{OH^-}{0,2}\)
\(\dfrac{H_2SO_4}{0,12}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,24}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\)
\(\dfrac{Ba\left(OH\right)_2}{0,4}\dfrac{\rightarrow}{ }\dfrac{Ba^+}{ }\dfrac{+}{ }\dfrac{2OH^-}{0,8}\)
\(\Rightarrow\dfrac{H^+}{\dfrac{1}{\dfrac{0,24}{0,76}}}\dfrac{+}{ }\dfrac{OH^-}{\dfrac{0,24}{\dfrac{0,24}{0}}}\dfrac{\rightarrow}{ }\dfrac{H_2O}{ }\)
\(\Rightarrow CM_{OH^-}=\left[OH^-\right]=\dfrac{0,76}{0,6}\simeq1,267\left(M\right)\)
vậy .......................................................................................................

đây nè: đề thi chọn hsg tỉnh 2015 - Hóa học 11 - Ngọc Hưng - Thư viện Đề thi & Kiểm tra

MY= 24,4 → Y chứa H2. Khí không màu hóa nâu ngoài không khí là NO → Y chứa NO và H2.
Gọi x và y lần lượt là số mol của H2 và NO
Ta có: x+ y= 0,125; 2x+ 30y= 0,125.24,4 → x= 0,025; y= 0,1
Vì có khí H2 thoát ra và Zn dư → H+ và NO3- hết → Muối thu được là muối clorua
Do nNO3(-)ban đầu= 0,15 mol > nNO= 0,1 mol→ X chứa NH4+
Theo bảo toàn nguyên tố N → nNH4+= 0,15-0,1= 0,05 mol
Theo bảo toàn electron: 2.nZn pứ= 3.nNO+ 8nNH4++ 2nH2= 0,75 mol→ nZn pứ= nZn2+= 0,375 mol
→mmuối= mZnCl2+ mNH4Cl+ mNaCl+ mKCl= 136. 0,375+ 53,5.0,05+ 58,5.0,05+ 74,5.0,1= 64,05 gam
Đáp án A

a) \(\left[OH^-\right]=10^4M\) \(\Rightarrow\left[H^+\right]=\dfrac{10^{-14}}{10^4}=10^{-18}\) \(\Rightarrow pH=18\)
Dung dịch A có môi trường Bazo.
b) \(NaOH\rightarrow Na^++OH^-\)
0,01 0,01
\(\Rightarrow\left[H^+\right]=\dfrac{10^{-14}}{0,01}=10^{-12}\) \(\Rightarrow pH=-log\left(10^{-12}\right)=12\)
Dung dịch B có môi trường bazo.
c) \(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\)
0,05 0,1
\(\Rightarrow\left[H^+\right]=\dfrac{10^{-14}}{0,1}=10^{-13}\) \(\Rightarrow pH=-log\left(10^{-13}\right)=13\)
Dung dịch C có môi trường bazo.