Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
1/2 X tác dụng với dung dịch NaOH thu được ít kết tủa hơn khi tác dụng với dung dịch Ba(OH)2, nên khi tác dụng với NaOH thì Ba2+ hết.
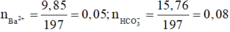
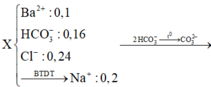
![]()
![]()

Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Đặt a, b, c là số mol Al203, CuO , FeO mA = 102a + 80b + 72c = 20,3 m rắn = 102a + 64b + 56c = 17,1 nHCl = 6a + 2b + 2c = 0,7 -> a = 0,05 ; b = c = 0,1 Trong B chứa nCO2 = b + c = 0,2 nCaCO3 = 0,1 -> nCa(HCO3)2 = 0,05 -> nCa(OH)2 = 0,15 -> Vdd =105 ml

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Al(x) Na(2x)
Na+H2O->NaOH + H2
2x -> 2x
Al + NaOH + H2O ->
x -> x
nNaOH dư x
NaOHdư + CuCl2 -> NaCl + Cu(OH)2
0,025 <- 0,025
NaOHdư + HCl -> ...
0,05 <- 0,05
----> nNaOH = (0,025.2 + 0,5).2 = 0,2
nAl = 0,1

Căn cứ vào các tính chất của các halogen ta thấy chỉ có C3H7Cl phản ứng được với dung dịch NaOH đun nóng. Đặt công thức của Y là RCl, phương trình phản ứng :
C3H7Cl + NaOH = C3H7OH + NaCl (1)
mol: x x
AgNO3 + NaCl = AgCl + NaNO3 (2)
mol: x x
Theo (1), (2) và giả thiết ta có :
nC3H7Cl = nNaCl = nAgCl = 1,435/143,5 = 0.01 mol;
mC6H5Cl = 1,91 - 0,01.78,5 = 1,125 gam.
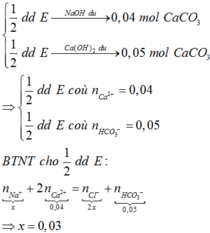
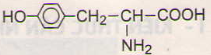 với các chất sau:
với các chất sau:
Đáp án A
Khi cho NaOH, hay Ca(OH)2 dư tác dụng 1/2 dd X, đều xảy ra phản ứng:
HCO3- + OH- → CO32- + H2O.(1)
Ca2+ + CO32- → CaCO3.(2)
Khi tác dụng Ca(OH)2 dư thì do Ca2+ và OH- dư nên n(↓ phần 2) = n(HCO3-) = 4,5/100= 0,045 mol.
Khi tác dụng NaOH dư, do OH- dư nên HCO3- phản ứng hết. với n(HCO3-) = 0,045. Trong khi n(↓ phần 1) = 2/100 = 0,02 < 0,045
⇒ kết tủa tính theo Ca2+ với n(Ca2+) = n(↓ phần 1) = 0,02 mol.
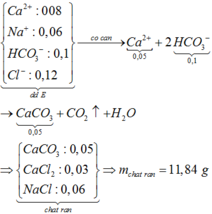
Bảo toàn điện tích ( trong 1/2 dd) → n(Na+) + 2n(Ca2+)=n(HCO3-) + n(Cl-)
=> n(Na+) = 0,045 + 0,035- 0,02.2= 0,04 mol
Khi đun sôi thu được muối chứa Na+( tính trong 1/2 dd): 2HCO3- → CO32- + CO2+ H2O
0,04 mol Na+; 0,02 mol Ca2+; 0,035 mol Cl-; 0,045/2 CO32-.
Khi nung nóng:
Ca2+ + CO32- → CaCO3
Ban đầu 0,02 0,0225
Sau phản ứng - 0,0025 0,02
CaCO3 → CaO + CO2
0,02 → 0,02
Chất rắn gồm: 0,04 mol Na+; 0,0025 mol CO32-; 0,035 mol Cl- và 002 mol CaO
→ m =2.( 0,04.23 + 0,0025.60 + 0,035.35,5 + 0,02.56) = 6,865 gam.