Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Gọi CT chung của 2 KL là A
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: A + 2HCl --> ACl2 + H2
_____0,15<---------------------0,15_______(mol)
=> \(\overline{M_A}=\dfrac{4,4}{0,15}=29,33\)
=> 2 kim loại là Mg, Ca
b) Gọi số mol Mg, Ca là a,b (mol)
=> 24a + 40b = 4,4 (1)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
_______a------------------------------>a_______(mol)
\(Ca+2HCl\rightarrow CaCl_2+H_2\uparrow\)
_a----------------------------->b_____________(mol)
=> a + b = 0,15 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{4,4}.100\%=54,55\%\\\%m_{Ca}=\dfrac{0,05.40}{4,4}.100\%=45,45\end{matrix}\right.\)

Chọn B
Gọi số mol các chất trong hỗn hợp đầu: M = a mol; M C O 3 = b m o l .


\(1.M+2HCl->MCl_2+H_2\\MCO_3+2HCl->MCl_2+CO_2+H_2O\\ n_A=4,48:22,4=0,2mol\\ n_{H_2}=a;n_{CO_2}=b\\ a+b=0,2\\ 2a+44b=0,2.11,5.2\\ a=b=0,1\\ 0,1\left(M+M+60\right)=10,8\\ M=24\left(Mg:magnesium\right)\\ b.\%V_{H_2}=\dfrac{0,1}{0,2}.100\%=50\%\\ \%V_{CO_2}=50\% \)
\(2.M:nguyên.tố.chung\\ a.M+2HCl->MCl_2+H_2\\ n_{H_2}=n_M=\dfrac{3,36}{22,4}=0,15mol\\ M_M=\dfrac{4,4}{0,15}=29,33\\ A,B:liên.tiếp\left(nhóm.IIA\right)\Rightarrow A:Mg\left(24\right),B:Ca\left(40\right)\\ n_{HCl\left(tt\right)}=0,25\cdot0,3:1=0,075\left(L\right)\)

Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ:
- Phân tử O2
Khi hình thành liên kết hoá học trong phân tử O2, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử oxygen góp chung 2 electron.
Phân tử O2 được biểu diễn như sau:


Đáp án A.
Gọi M là nguyên tử khối trung bình của 2 kim loại A và B
Khi đó công thức oxit chung là ![]()
Ta có phản ứng
![]()
0,03 0,18
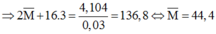
Suy ra phải có 1 kim loại có nguyên tử khối bé hơn 44,4 và 1 kim loại có nguyên tử khối lớn hơn 44,4
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối nhỏ hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Al (A = 27; Z = 13)
Kim loại còn lại có số hiệu nguyên tử bằng (A = 56)
Tổng số khối khi đó là 27 + 56 = 83
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối lớn hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Ga (A = 70; Z = 31)
Kim loại còn lại có số hiệu nguyên tử:


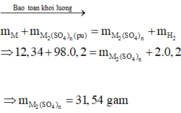

- Nguyên tử O với cấu hình electron là 1s22s22p4, có 6 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của O là -2.
O + 2e → O2-
- Nguyên tử kim loại nhóm IA có cấu hình electron chung là ns1, có 1 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IA là +1.
- Nguyên tử kim loại nhóm IIA có cấu hình electron chung là ns2, có 2 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IIA là +2.
- Nguyên tử Al với cấu hình electron là [Ne]3s23p1, có 3 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 3 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của Al là +3.
Al → Al3+ + 3e