

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12

Đáp án D
Nhiệt phân thấy mhh X giảm 1,44g ⇒ mH2O tách từ bazo = 1,44g.
⇒ Quy hỗn hợp X gồm: mX = mKim loại + mO + mH2O.
Phản ứng với HCl: Đặt nO/X = a ta có:
2a + 2nH2 = nHCl ⇔ nO/X = 0,58 mol.
⇒ mKim loại trong X = m – mO – mH2O = m – 10,72 gam.
●Phản ứng với HNO3 có thể sinh ra muối NH4NO3:
Đặt nNH4NO3 = b ta có:
mMuối = m + 108,48 = mKim loại + mNO3–/Muối kim loại + mNH4NO3.
⇔ m + 108,48 + (m – 10,72) + (2nO + 3nNO + 8nNH4NO3)×62 + 80b.
⇔ m + 108,48 + (m – 10,72) + (0,58×2 + 0,2×3 + 8b)×62 + 80b ⇔ b = 0,0175 mol.
⇒ ∑nHNO3 đã pứ = 10nNH4NO3 + 4nNO + 2nO = 2,135 mol

Đáp án A
Đặt số mol ![]() lần lượt là x, y , z mol
lần lượt là x, y , z mol
Hỗn hợp khí có 30 > M > 21,6 >2 và có 1 khí hóa nâu => Z gồm
![]()
Khi đó ta có hệ

Vì sinh ra H 2 nên toàn bộ lượng
![]()
chuyển hóa thành NO : 0,07 mol và N H 4 +
Bảo toàn nguyên tố
N![]()
Luôn có:
![]()
=> 1,04 +0,08 = 2.0,03 + 0,07+10x(2z+0,01)+2.4y ⇔ 8y + 20z = 0,68
Trong 20,8 gam chất rắn gồm MgO: x mol và F e 2 O 3 : 0,5.(3y+z)
Ta có hệ:
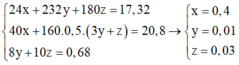
Bảo toàn electron cho toàn bộ quá trình
![]()
![]()
![]()
![]()
=>Kết tủa thu được
![]()
![]()

– Phần 2: naxit = nkhí thoát ra = 0,2 mol
→ Giả sử Z là CH3OH
→ Axit là HCOOH → nAg tạo ra > 0,2.2 = 0,4 → Loại
Z có dạng RCH2OH (R khác H) → nRCHO = nAg : 2 = 0,2 mol
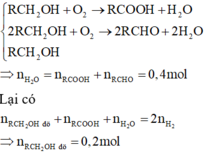
Rắn khan gồm: 0,2 mol RCH2ONa; 0,2 mol RCOONa; 0,4 mol NaOH.
→ 0,2.(MR + 53) + 0,2.(MR + 67) + 0,4. 40 = 51,6 g.
→ MR = 29 → Z là C3H7OH với số mol: 0,6.3 = 1,8 mol = nKOH đã phản ứng
→ KOH dư 0,6 mol
→ 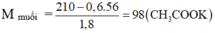
→ Este X là CH3COOC3H7 → X là propyl axetat
→ Đáp án B