Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{BaSO_3}=\dfrac{21.7}{217}=0.1\left(mol\right)\)
\(BTBa:\)
\(n_{Ba\left(HSO_3\right)_2}=0.2\cdot0.75-0.1=0.05\left(mol\right)\)
\(BTS:\)
\(n_{FeS_2}=\dfrac{0.1+0.05\cdot2}{2}=0.1\left(mol\right)\)
\(m_{FeS_2}=0.1\cdot120=12\left(g\right)\)
$n_{Ba(OH)_2} = 0,2.0,75 = 0,15(mol)$
$n_{BaSO_3} = 0,1(mol)$
TH1: $Ba(OH)_2$ dư
Ba(OH)2 + SO2 → BaSO3 + H2O
0,1..............0,1.........0,1........................(mol)
Bảo toàn nguyên tố với S :
$n_{FeS_2} = \dfrac{1}{2}n_{SO_2} = 0,05(mol)$
$m = 0,05.120 = 6(gam)$
TH2 : Có tạo muối axit
Ba(OH)2 + SO2 → BaSO3 + H2O
0,1..............0,1.........0,1........................(mol)
Ba(OH)2 + 2SO2 → Ba(HSO3)2
0,05.............0,1........................................(mol)
$n_{SO_2} = 0,2(mol)$
$n_{FeS_2} = \dfrac{1}{2}n_{SO_2} = 0,1(mol)$
$m = 0,1.120 = 12(gam)$

\(n_{hh}=\dfrac{V_{hh}}{22,4}=\dfrac{1,68}{22,4}=0,075mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2\left(CH_4\right)}=x\\n_{CO_2\left(C_2H_4\right)}=2y\end{matrix}\right.\)
\(n_{CaCO_3}=\dfrac{m_{CaCO_3}}{M_{CaCO_3}}=\dfrac{10}{100}=0,1mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
x+2y x+2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}22,4x+22,4y=1,68\\x+2y=0,1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,025\end{matrix}\right.\)
\(\%CH_4=\dfrac{0,05}{0,075}.100=66,66\%\)
\(\%C_2H_4=100\%-66,66\%=33,34\%\)
\(m_{CH_4}=0,05.16=0,8g\)
\(m_{C_2H_4}=0,025.28=0,7g\)

Tính được nBa(OH)2= nKOH= 0,2 mol; nBaSO3= 0,15 mol
Dung dịch Y + NaOH → Kết tủa →chứng tỏ Y có Ba(HSO3)2
Vậy sau phản ứng có các muối BaSO3, Ba(HSO3)2, KHSO3
(Không thể có K2SO3 hoặc kiềm dư vì chúng đối kháng với Ba(HSO3)2)
Các phương trình hóa học:
2FeS2 + 11/2 O2 → Fe2O3+ 4SO2 (1)
SO2+ Ba(OH)2 → BaSO3 + H2O (2)
0,15 0,15 0,15 mol
2SO2 + Ba(OH)2 →Ba(HSO3)2 (3)
0,1 ← (0,2-0,15) mol
SO2+ KOH → KHSO3 (4)
0,2 0,2 mol
Tổng số mol SO2 là 0,15 + 0,1+ 0,2= 0,45mol
Theo PT (1): nFeS2= 0,5. nSO2=0,225 mol → mFeS2= 0,225. 120 = 27 gam
*Tk
Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa
=>Dung dịch Y hình thành đồng thời SO32- và HSO3-
Ta có : nBaSO3 = 0,1 mol < nBa(OH)2 =0,15 mol
=>Kết tủa tính theo SO32- :0,1 mol
SO2 + 2OH- → SO32- + H2O
0,1......0,2......0,1
SO2 + OH- → HSO3-
0,2........(0,4-0,2)
=> nSO2 = 0,3 mol
Bảo toàn nguyên tố S: \(n_{SO_2}=n_{FeS_2}.2\)
=> nFeS2 = 0,15 mol
=> m = 18 gam.

PTHH
M+H2O=MOH+1/2H2 (1)
A a a a/2
2MOH+CO2=M2CO3+H2O (2)
A a/2 a/2 a
M2CO3 +CO2 +H2O =2MHCO3 (3)
0.3-0.5a 0.3-0.5a 0.3-0.5a 0.6-a
Dd B gồm: M2CO3 có n=a-0.3 và MHCO3 có n=0.6-a
Phần 1:
Ca(NO3)2+M2CO3=CaCO3+2MNO3 (4)
0.1 0.1 0.1 0.2
Từ PTHH 4: 0.5a-0.3+0.5a=0.1 => a=0.5 => M là Na
2MHCO3=M2CO3+CO2+H2O (5)
0.05 0.025 0.025 0.025
M2CO3+Ca(NO3)2=CaCO3+2MNO3 (6)
0.025 0.025 0.025 0.05
=> m=2.5g
V=5.6l
Gọi công thức của tinh thể là
Na2CO3.xH2O
=> x=15

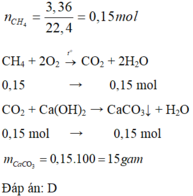
đốt cháy hoàn toàn m gam fes2 và lấy toàn bộ sản phẩm khí thu đc cho hấp thụ hết bởi 5000 ml dd ca(oh)2 1M thu đc 12g kết tủa đun nóng dd thu đc sau phảm ứng thấy xuất hiện kết tủa nữa. tinh m
Chất khí thoát ra là SO2
\(n_{Ca\left(OH\right)_2}=5\left(mol\right)\)
\(n_{CaSO_3}=0,1\left(mol\right)\)
Do sau khi đun nóng dung dịch thu được kết tủa nữa nên dung dịch là Ca(HSO3)2
Bảo toàn nguyên tố Ca => \(n_{Ca\left(HSO_3\right)_2}=5-0,1=4,9\left(mol\right)\)
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{CaSO_3}.1+n_{Ca\left(HSO_3\right)_2}.2=4,95\left(mol\right)\)
=> \(m_{FeS_2}=4,95.120=594\left(g\right)\)