Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
· Đặt CTTQ của cao su đã lưu hóa là (C5H8)aSb (x mol)
·SO2 + Br2 + 2H2O → H2SO4 + 2HBr
![]()
![]()
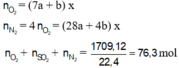
5ax + (28a + 4b) x + 0,1 = 76,3 33ax + 4bx = 76,2 ax = 2,297
m = 68ax + 32bx = 68.2,297 + 32.0,1 = 159,4 gam

Đáp án C
Định hướng tư duy giải
Chú ý: Đốt cháy peptit hay muối tương ứng thì số mol O2 cần là như nhau.
Bình không khí chứa
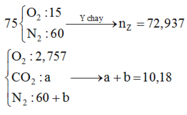
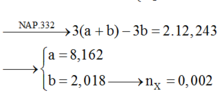

Chọn đáp án C
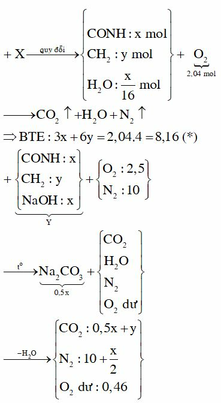
X là X16. phương trình biến đổi peptit: X16 + 7H2O → 8X2 (*).
Một chú ý quan trọng: đốt X2 hay đốt X17 hay đốt muối Y đều cần cùng một lượng O2 thêm nữa, X2 + 2NaOH → Y + 1H2O; đốt Y cho x mol Na2CO3 (với n X 2 = x mol) 12,5 mol không khí gồm 2,5 mol O2 và 10 mol N2 kk thì chỉ cần 2,04 mol O2 để đốt còn 0,46 mol O2 dư và 10 mol N2 trong Z; vì ngưng tụ hơi nước nên trong Z còn
n N 2 peptit + n C O 2 = 1,68 mol; mà n N 2 peptit = n X 2 = x mol ||→ ngay ∑nC trong X = 1,68 mol.
Rút gọn lại vừa đủ: đốt x mol đipeptit X2 dạng CnH2nN2O3
cần 2,04 mol O2 thu được cùng 1,68 mol H2O + 1,68 mol CO2 + x mol N2.
bảo toàn O có: 3x + 2,04 × 2 = 3 × 1,68. Giải ra x = 0,32 mol.
||→ mđipeptit X2 = 1,68 × 14 + 76x = 47,84 gam; n H 2 O trung gian ở (*) = 0,28 mol
||→ yêu cầu m = mX17 = 47,84 – 0,28 × 18 = 42,8 gam.

Chọn đáp án D
• 21,33 gam C 5 n H 8 n - 1 S 2 + O 2 → 5 n C O 2 + 4 n - 1 H 2 O + 2 S O 2
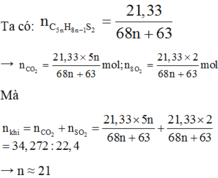

Đáp án D
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g

Giải thích:
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=> 3x + 6z = 2y + 0,15 + 0,1 + 8t (1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=> t + 3x = 2z (2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13 (3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=> 1,36 = 32z – 16.(1,5x – y) (4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g
Đáp án D

Đáp án A
Cứ có một cầu nối – S – S – được tạo ra thì mạch cao su sẽ mất đi 2H. Vậy số S thêm vào bằng số H mất đi