Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
mdung dịch giảm = mkết tủa - m(CO2 + H2O) → 17 = 40 – m(CO2 + H2O) → m(CO2 + H2O) = 23 g
nkết tủa = nCO2 = 0,4 => mCO2 = 17,6 => mH2O = 5,4 => nH2O = 0,3
Gọi CTCT là RCOOR’
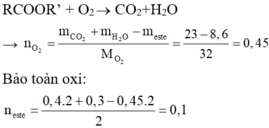
→ Meste=86 → CTPT C4H6O2
Có nRCOOR’ = 0,1 mol → nRCOOK = 0,1 mol
mrắn= mKOH dư + mmuối
→ mmuối=19,4 – (0,25 – 0,1).56 = 11 → Mmuối = 110
→ MRCOO = 110-39 = 71 R là CH2=CH-
→ X là CH2=CHCOOCH3 → X là Metyl acrylat

Đáp án A
Nhận thấy H đều có công thức CnH2n-2O2
Khi đun nóng Y lại thu được thêm kết tủa → chứng tỏ hình thành BaCO3 : 0,03 mol và Ba(HCO3)2 : 0,13- 0,03 = 0,1 mol
Bảo toàn nguyên tố C → nCO2 = nBaCO3 + 2nBa(HCO3)2 = 0,03 + 0,2 = 0,23 mol
mdd tăng = mCO2 + mH2O - mBaCO3
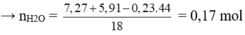
→ nH = nCO2 - nH2O = 0,23- 0,17 = 0,06 mol
mhỗn hợp = mC + mH + mO
= 0,23.12 + 0,17.2 + 0,06.2.16 = 5,02 gam

Đáp án là D
![]()
Bảo toàn khối lượng cho phản ứng cháy ⇒ n O 2 = 2 , 225
Bảo toàn O=> n O ( X ) = 1 , 2 ⇒ n C O O = 0 , 6
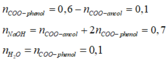
Bảo toàn khối lượng => m muối = 57,9

Đáp án A
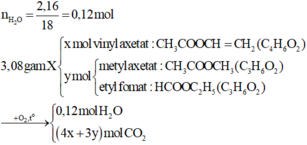
=> 86x + 74y = 3,08 (1)
Đặt công thức chung của ba chất là CnH6O2.
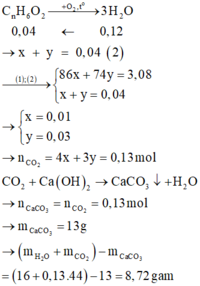
→ Khối lượng dung dịch B so với dung dịch A tăng 8,72 gam.

Chọn đáp án A
Đốt cháy 10,58g hỗn hợp X gồm 3 este đơn chức, mạch hở ta có: ![]() .
.
Mặt khác hidro hóa hoàn toàn 10,58 g hỗn hợp X cần 0,07 mol H2. Vậy 0,07 mol H2 chính là số mol liên kết π trong mạch Cacbon của 3 este.
![]()
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
![]()
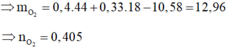
Áp dụng định luật bảo toàn nguyên tố O ta có:
![]()
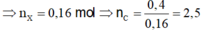
Vậy phải có 1 este có 2C. Vậy este đó phải là ![]() .
.
Theo đề bài ta thấy thủy phân Y trong NaOH chỉ thu được 1 ancol duy nhất, vậy ancol đó là CH3OH.
Vậy CT trung bình của 3 este sau khi hidro hóa là ![]() .
.
![]()
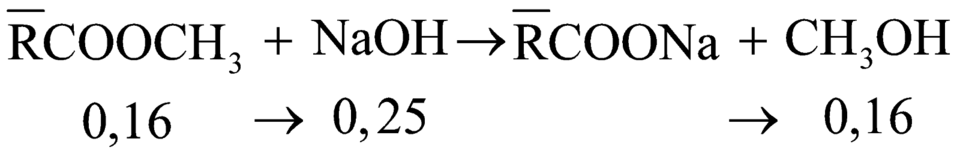
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
![]()
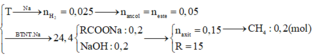
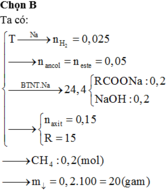

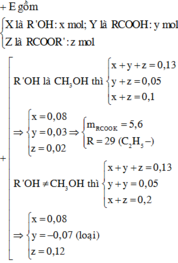
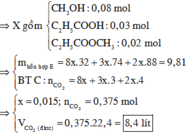
Đáp án là A
mdung dịch giảm =mkết tủa - m(CO2+H2O)
nkết tủa=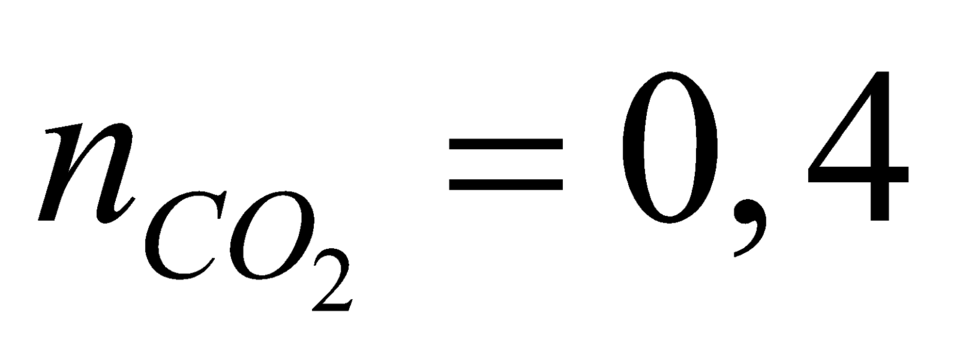
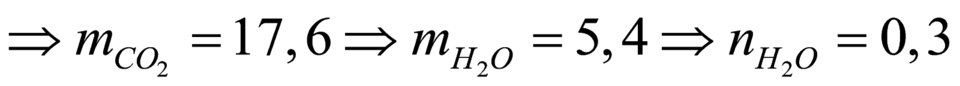
Gọi CTCT là RCOOR’
có RCOOR’ + O2 CO2+H2O
CO2+H2O
Bảo toàn oxi
Có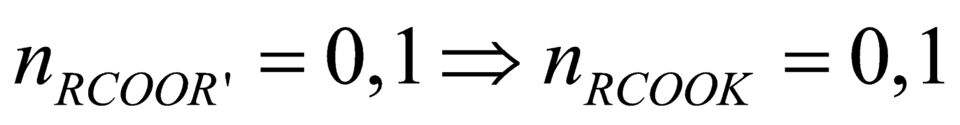
mrắn=mKOH dư + mmuối
=11 Mmuối=110
R là CH2=CH-