Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

áp dụng ĐLBTKL:
mR + mO2 = mR2O3
=> mO2=20,4-10,8=9,6(g)
=> nO2=9,6/32=0,3(mol)
4R + 3O2 ---to---> 2R2O3
0,4........0,3
MR=10,8/0,4=27(g)
=> R là nhôm ......Al

a/ Ta có: \(n_{Mg}=\dfrac{4.8}{24}=0.2\left(mol\right)\)
PTHH:
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 1
0.2 x
\(=>x=\dfrac{0.2\cdot1}{2}=0.1=n_{O_2}\)
\(=>V_{O_2\left(đktc\right)}=0.1\cdot22.4=2.24\left(l\right)\)
b/ \(2Mg+O_2\underrightarrow{t^o}2MgO\)
2 2
0.2 y
\(=>y=\left(0.2\cdot2\right):2=0.2=n_{MgO}\)
\(=>m_{MgO}=0.2\cdot\left(24+16\right)=8\left(g\right)\)

\(a) 4P+ 5O_2 \xrightarrow{t^o} 2P_2O_5\\ b) n_{O_2} = \dfrac{1,12}{22,4} = 0,05(mol)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,02(mol)\\ m_{P_2O_5} = 0,02.142 = 2,84(gam) c) 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{0,1}{3}(mol)\\ m_{KClO_3} = \dfrac{0,1}{3}122,5 = 4,083(gam)\)

2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=0,1 mol
nO2=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=6,5/65=0,1 mol
n O2=0,8/32=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g

\(n_{Na_2O}=\dfrac{124}{62}=2\left(mol\right)\)
PTHH: 4Na + O2 --to--> 2Na2O
1<----------2
=> mO2 = 1.32 = 32 (g)

\(n_{N_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(N_2+O_2\underrightarrow{t^o}2NO\)
0,15 0,2 0
0,15 0,15 0,3
0 0,05 0,3
Sau phản ứng oxi còn dư và dư \(m=0,05\cdot32=1,6g\)
\(m_{NO}=0,3\cdot30=9g\)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)

Gọi CTHH của oxit sắt là: \(Fe_xO_y\)
Ta có: \(n_{Fe_xO_y}=\dfrac{23,2}{56x+16y}\left(mol\right)\)
\(\Rightarrow m_{Fe_{\left(Fe_xO_y\right)}}=\dfrac{23,2}{56x+16y}.56x=\dfrac{1299,2x}{56x+16y}\left(g\right)\)
\(\Rightarrow\dfrac{1299,2x}{56x+16y}=16,8\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Vậy CTHH của oxit sắt là: Fe3O4

Bài 1 :
Gọi nguyên tố cần tìm là X
Ta có CTHH : X2O3
noxi = \(\frac{V}{22,4}\)= \(\frac{3,36}{22,4}\)= 0,15 (mol)
PTHH : 4X + 3O2 -> 2X2O3
4mol 3mol 2mol
0,2 0,15 0,1
\(M^{_{X_2O_3}}\)= \(\frac{m}{n}\)= \(\frac{10,2}{0,1}\)= 102 (g/mol)
=> 2.X + 3.O2 = 102 \(n_{O_2}\)
2.X + 3.16 = 102
2.X = 102 - 48 = 54
X = 54 : = 27 (g/mol)
Vậy X là Al ( nhôm)
Bài 2 :
Gọi nguyên tố cần tìm là R
Ta có CTHH : RO
\(n_{O_2}\)= \(\frac{V}{22,4}\)= \(\frac{8,4}{22,4}\)= 0,375 (mol)
PTHH: 2R + O2 -> 2RO
2mol 1mol 2mol
0,75 0,375 0,75
MR = \(\frac{m}{n}\)= \(\frac{18}{0.75}\)= 24 (g/mol)
Vậy R là Mg ( Magie)
Bài 2:
Gọi CTHH của kim loại có hóa trị II cần tìm là X.
PTHH: 2X + O2 -> 2XO
Ta có:
\(n_{O_2}=\frac{8,4}{22,4}=0,375\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(n_R=2.n_{O_2}=2.0,375=0,75\left(mol\right)\)
=> \(M_R=\frac{18}{0,75}=24\left(\frac{g}{mol}\right)\)
Vậy: Kim loại R có hóa trị II cần tìm là Mg (magie).
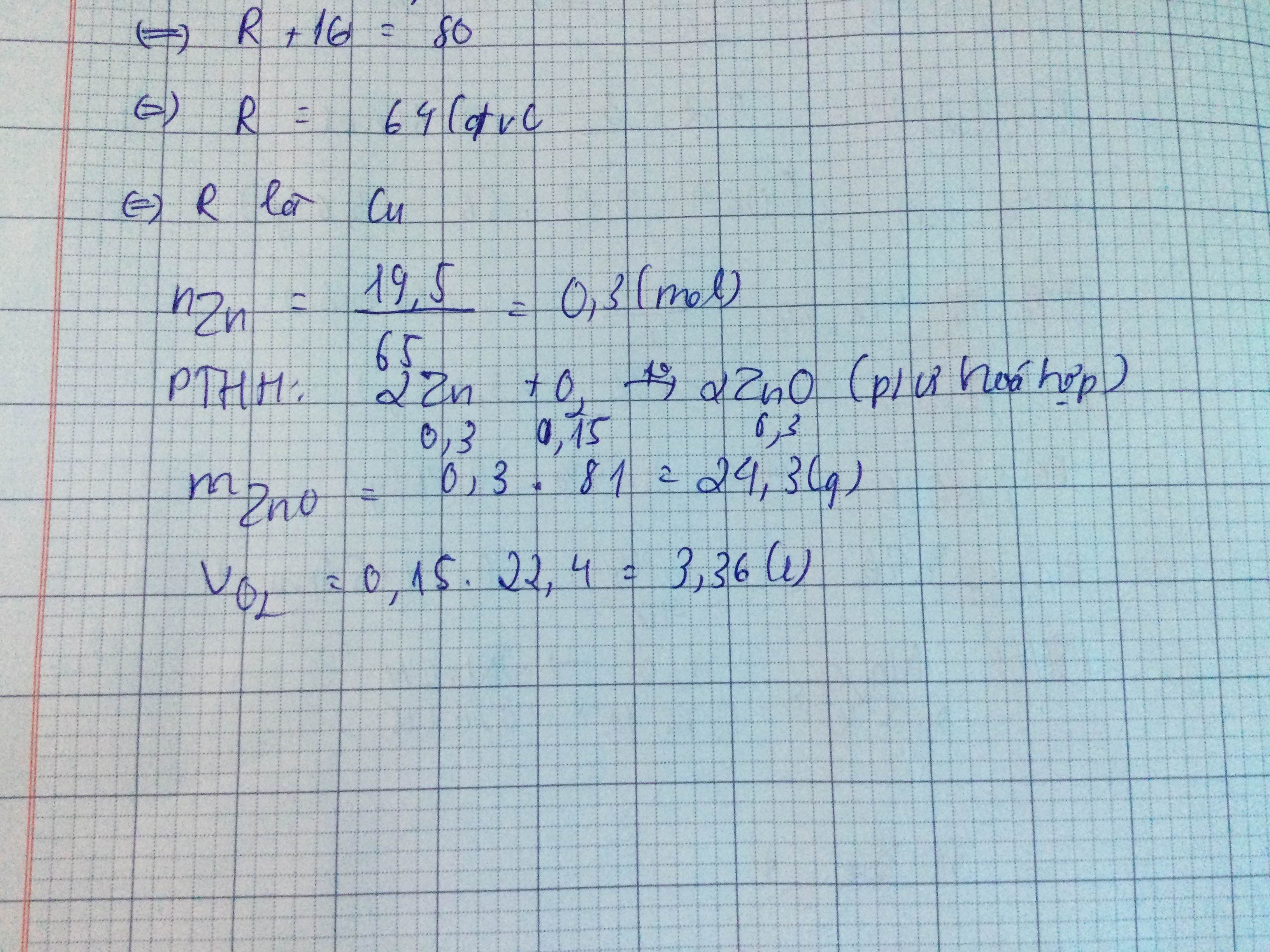
Vì x là Kim Loại nên X có thể nhận 3 hóa trị : I ; II ; III
Xét X có Hóa trị là I
PTHH : 4X + O2 -----> 2X2O
Phản Ứng Xảy Ra Hoàn Toàn
nX = \(\dfrac{22,4}{X}\)
=> nX2O = \(\dfrac{22,4}{X}\cdot\dfrac{2}{4}=\dfrac{11,2}{X}\)
Mà nX2O = \(\dfrac{32}{2X+16}\)
=> \(\dfrac{11,2}{X}=\dfrac{32}{2X+16}\)
=> 22,4X + 179,2 = 32X
=> 179,2 = 9,6X (Loại)
Xét X có Hóa trị là II
PTHH : 2X + O2 -----> 2XO
nX = \(\dfrac{22,4}{X}\)
=> nXO = \(\dfrac{22,4}{X}\)
Mà nXO = \(\dfrac{32}{X+16}\)
=> \(\dfrac{22,4}{X}=\dfrac{32}{X+16}\)
=> 22,4X + 358,4 = 32X
=> 358,4 = 9,6X (loại)
Xét X có hóa trị là III
PTHH : 4X + 3O2 ----> 2X2O3
nX = \(\dfrac{22,4}{X}\)
=> nX2O3 = \(\dfrac{22,4}{X}\cdot\dfrac{2}{4}\)= \(\dfrac{11,2}{X}\)
Mà nX2O3 = \(\dfrac{32}{2X+48}\)
=> \(\dfrac{11,2}{X}=\dfrac{32}{2X+48}\)
=> 22,4X + 537,6 = 32X
=> 537,6 = 9,6X
=> 56 = X (Fe)
Vậy X là Fe (III)
Bài làm của em đúng, nhưng làm thế này rất dài. Em nên gọi hóa trị của kim loại là n. Suy ra công thức oxit là X2On. Sau đó viết PTHH dưới dang tổng quát. Lập 1 bảng các giác trị n=1,2,3 để giải ra nghiệm