Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức phân tử của hợp chất A :
Số mol các sản phẩm của phản ứng :
n SO 2 = 0,1 mol; n H 2 O = 0,1 mol
Khối lượng của hiđro có trong 0,1 mol H 2 O (2 g.0,1 = 0,2 g) và khối lượng của lưu huỳnh có trong 0,1 mol SO 2 (32 g.0,1 = 3,2 g) đúng bằng khối lượng của hợp chất A đem đốt (3,4 g).
Vậy thành phần của hợp chất A chỉ có 2 nguyên tố là H và S.
- Tỉ lệ giữa số mol nguyên tử H và số mol nguyên tử S là :
n H : n S = 0,1.2 : 0,1 = 2 : 1
Công thức phân tử của hợp chất A là : H 2 S

Phương trình hóa học của phản ứng:
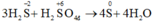
Do H2S có tính khử và H2SO4 có tính oxi hóa nên chúng có khả năng tác dụng với nhau sinh ra kết tủa vàng là S
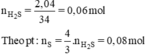
mS = 0,08 × 32 = 2,56g.

PTHH của phản ứng đốt cháy H 2 S
2 H 2 S + 3 O 2 → 2 H 2 O + 2 SO 2

Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol SO 2 (0,1 mol) vậy sản phẩm là muối Na 2 SO 3 . Ta có PTHH :
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
- Khối lượng của dung dịch sau phản ứng :
m dd = 146,6 + 3,4 = 150 (g)
- Khối lượng các chất có trong dung dịch sau phản ứng :
m Na 2 SO 3 = 126.0,1 = 12,6g
m NaOH dư = 40.(0,3 - 0,2) = 4g
- Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C % Na 2 SO 3 = 12,6/150 x 100% = 8,4%
C % NaOH dư = 4/150 x 100% = 2,67%

Đáp án A.
Đốt cháy X thu đc SO2 vào H2O => Trong X có S,H và có thể có O
Trong 64 SO2 có 32g S
7.04______x g S
x = 3,52g => nS = 0,11 (mol)
Trong 18g H2O có 2g H
1.98 y g H
y = 0,22g => nH = 0,22(mol)
mO = 3.74 - 3.52 - 0.22 = 0
Vậy trong X có H và S
Gọi CT X là HxSy
Ta có: x:y = 0, 22: 0,11 = 2:1
=> CT X: H2S

n H2O = 1,08 / 18 = 0,06 (mol)
=> nH = 0,06 x 2 = 0,12 (mol)
=> mH = 0,12 x 1 = 0,12 (g)
n SO2 = 1,344 / 22,4 = 0,06 (mol)
=> n S = 0,06 (mol)
=> m S = 0,06 x 32 = 1,92 (g)
Vì: mO = mhh - mS - mH = 2,04 - 1,92 - 0,12 = 0 => Không có Oxi
Gọi HxSy là chất cần tìm
nH : nS = 0,12 : 0,06 = 2 : 1
=> Công thức đơn giản là (H2S)n
(H2S)n + 3n/2O2 --> nH2O + nSO2
____ __ _ __ _ _ _ _ 0,06 ----> 0,06n
lấy số mol nước đẩy qua số mol SO2 thì thấy 0,06n = 0,06 => n = 1
n H2S = 0,06 (mol)
Vậy đó là công thức H2S
2AgNO3 + H2S --> Ag2S + 2HNO3
0,06 ----> 0,06
=> m Ag2S = 0,06 x 248 = 14,88 g

a)
n CO2 = 403,2/1000.22,4 = 0,018(mol)
n H2O = 0,27/18 = 0,015(mol)
Bảo toàn nguyên tố với C,H :
n C = n CO2 = 0,018(mol)
n H = 2n H2O = 0,015.2 = 0,03(mol)
=> n O = (0,486 - 0,018.12 - 0,03.1)/16 = 0,015(mol)
n C : n H : n O = 0,018 : 0,03 : 0,015 = 6 : 10 : 5
=> CTP là (C6H10O5)n
M A = 162n < 170 => n <1,049
=> n = 1
Vậy CTPT của A là C6H10O5
b)
A có 1 -OH và 1 -COOH
CTCT của A : HO-CH2-CH2-COO-CH2-CH2-COOH
B : HO-CH2-CH2-COONa
$HO-CH_2-CH_2-COOCH_2-CH_2-COOH + 2NaOH \to 2HO-CH_2-CH_2-COONa + H_2O$
a)
n CO2 = 403,2/1000.22,4 = 0,018(mol)
n H2O = 0,27/18 = 0,015(mol)
Bảo toàn nguyên tố với C,H :
n C = n CO2 = 0,018(mol)
n H = 2n H2O = 0,015.2 = 0,03(mol)
=> n O = (0,486 - 0,018.12 - 0,03.1)/16 = 0,015(mol)
n C : n H : n O = 0,018 : 0,03 : 0,015 = 6 : 10 : 5
=> CTP là (C6H10O5)n
M A = 162n < 170 => n <1,049
=> n = 1
Vậy CTPT của A là C6H10O5
b)
A có 1 -OH và 1 -COOH
CTCT của A : HO-CH2-CH2-COO-CH2-CH2-COOH
B : HO-CH2-CH2-COONa
HO−CH2−CH2−COOCH2−CH2−COOH+2NaOH→2HO−CH2−CH2−COONa+H2O

Xác định công thức phân tử của hợp chất A
Như vậy hợp chất A chỉ có nguyên tố S và H (Do mS + mH = 1,92 + 0,12 = 2,04 =mA)
Đặt công thức phân tử hợp chất là HxSy
Ta có tỉ lệ x : y = nH : nS = 0,12 : 0,06 = 2 : 1
Vậy công thức phân tử của A và là H2S.