Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi k là số liên kết π trong X => nCO2 – nH2O = (k – 1).nX
=> nπ(X) – nX = nCO2 – nH2O
Đặt x là số mol gốc COO có trong X => nO(X) = 2x mol và nπ (COO) = x mol
- Khi đốt cháy X: Bảo toàn Oxi: nO(X) + 2nO2 = 2nCO2 + nH2O
=> 2x + 2.1,27 = 2nCO2 + 0,8
=> nCO2 = (0,87 + x) mol
=> nπ (X) = nCO2 – nH2O + nX = (0,87 + x) – 0,8 + 0,33 = 0,4 + x
Vì chỉ có liên kết π ngoài COO mới phản ứng được với Br2
=> nπ (gốc hidrocacbon) = nπ (X) – nπ (COO) = (0,4 + x) – x = 0,4 mol
=> nBr2 = 0,4 mol
Đáp án cần chọn là: A

Đáp án A
Chú ý: Do việc nhấc các nhóm COO trong este và axit ra không ảnh hưởng gì tới bài toán nên ta ném COO đi biến X thành X’ chỉ là các hidrocacbon.
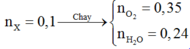
Ta có:
![]()
![]()
![]()

Đáp án D
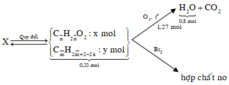
X ( 0 , 33 m o l ) C 3 H 6 O 2 C 4 H 8 O 2 C x H y ( a m o l ) + O 2 ( 1 , 27 m o l ) → H 2 O ( 0 , 8 m o l ) + C O 2
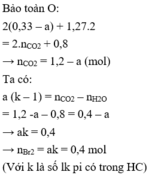

Chọn A.
Quy đổi:
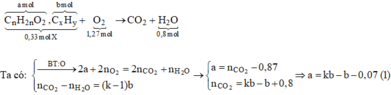
với k là số liên kết p trong phân tử của 2 hiđrocacbon).
Kết hợp (1) với a + b = 0,33 ta suy ra: kb = 0,4 mol
Khi cho 0,33 mol X tác dụng với Br2 thì: n B r 2 = k n C x H y = k b = 0 , 4 m o l

Đáp án C
Với phản ứng đốt cháy ta nhấc nhóm COO: 0,08 mol ra ngoài
Ta có:
![]()
![]()

Chọn đáp án D
Đặt CTTQ của là CxHyOz ta cớ pứ cháy:
CxHyOz + (x + 0,25y – 0,5z)O2 → xCO2 + 0,5yH2O.
PT theo nH2O ⇒ nH2O = 0,1×0,5y = 0,2 ⇒ y = 4.
PT theo nO2 ⇒ nO2 = 0,1×(x + 0,25y – 0,5z) = 0,28
⇒ x – 0,5z = 1,8
+ Ta có độ bất bão hòa của X = k = (2x + 2 – y) ÷ 2
⇒ Số liên π giữa cacbon và cacbon = (2x + 2 – y) ÷ 2 – z÷2 = x – 0,5z = 0,8
⇒ nBr2 pứ = 0,1 × 0,8 = 0,08 mol

Đáp án C.
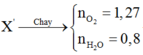
Áp dụng kỹ thuật dồn chất ta sẽ kéo COO và NH ra khỏi X → X’
Khi đốt X’
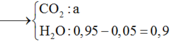
![]()
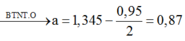
![]()
![]()
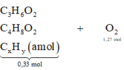
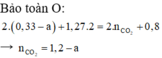

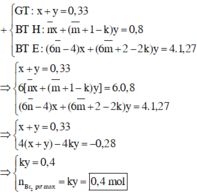
Chọn đáp án A
X gồm C2H5COOCH3, CH3COOCH3 và CaHb.
Đặt neste = x mol ⇒ nhiđrocacbon = 0,495 – x mol.
nH2O = 1,2 mol ⇒ bảo toàn nguyên tố Oxi có:
nCO2 = (2x + 1,905 × 2 – 1,2)/2 = x + 1,305 mol.
tương quan đốt:
nCO2 – nH2O = (k – 1).nhỗn hợp
= k.nhỗn hợp - nhỗn hợp = ∑nπ - nhỗn hợp
(với k là tổng số liên kết π trong hỗn hợp).
Thay số liệu:
(x + 1,305) – 1,2 = (nBr2 + x) – 0,495
⇒ nBr2 = 0,6 mol.
⇒ ứng với 0,5775 mol X thì nBr2 phản ứng = 0,7 mol