Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{Br_2}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,05<-0,05
=> \(n_{CH_4}=\dfrac{3,36}{22,4}-0,05=0,1\left(mol\right)\)
\(\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,05.28}.100\%=53,33\%\)
\(\%m_{C_2H_4}=\dfrac{0,05.28}{0,1.16+0,05.28}.100\%=46,67\%\)
b)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,1-->0,2
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05--->0,15
=> \(V_{O_2}=\left(0,2+0,15\right).22,4=7,84\left(l\right)\)

a) Gọi: nCH4= x mol; nC2H4= y mol
nhỗn hợp= x +y= 0,15 mol (1)
mhỗn hợp= 16x + 28y = 3 (g) (2)
→Giải hệ hai phương trình (1) và (2) ta được: x= 0,1 mol; y= 0,05 mol
→VCH4= 0,1x22,4= 2,24 (l) →VC2H4=1,12 (l)
b) Trong 1,68l hỗn hợp khí có: 0,05 mol CH4 và 0,025 mol C2H4
C2H4 + Br2→ C2H4Br2
→khối lượng đung dịch tăng thêm chính là khối lượng C2H4 → m= mC2H4= 0,025x28 = 0,7 (g)
c) CH4 + 2O2 → CO2 + 2H2O
0,1 mol 0,2 mol
C2H4 + 3O2 → 2CO2 + 2H2O
0,05 mol 0,15 mol
→Tổng số mol oxi cần để đốt cháy 3,36 lít hỗn hợp CH4 và C2H4: nO2= 0,2+0,15= 0,35 mol
→VO2= 0,35x22,4=7,84 (l) → Vkhông khí= 7,84x100/20 = 39,2 (l)

a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)

nhh khí = 3,36/22,4 = 0,15 (mol)
mBr2 = 200 . 10% = 20 (g)
nBr2 = 20/160 = 0,125 (mol)
PTHH: C2H2 + 2Br2 -> C2H2Br4
Mol: 0,0625 <--- 0,125 ---> 0,0625
%VC2H2 = 0,0625/0,15 = 41,66%
%VCH4 = 100% - 41,66% = 58,34%
nCH4 = 0,15 - 0,0625 = 0,0875 (mol)
PTHH:
2C2H2 + 5O2 -> (t°) 4CO2 + 2H2O
0,0625 ---> 0,15625
CH4 + 2O2 -> (t°) CO2 + 2H2O
0,0875 ---> 0,175
Vkk = 22,4 . (0,175 + 0,15625) . 5 = 37,1 (l)

a) Khi cho metan và axetilen qua dung dịch brom thì metan không phản ứng với brom nên thoát ra khỏi bình còn axetilen phản ứng với dung dịch brom.
=> 20,16 lít khí thoát là metan CH4
=> V axetilen = 40,32 - 20,16 = 20,16 lít
<=> %V CH4 = %V C2H2 = 50%
b)
nCH4 = nC2H2 = \(\dfrac{20,16}{22,4}\)= 0,9 lít
CH4 + 2O2 → CO2 + 2H2O
C2H2 + \(\dfrac{5}{2}\)O2 → 2CO2 + H2O
Theo tỉ lệ phản ứng cháy => nO2 cần để đốt cháy hết hỗn hợp khí = 2nCH4+\(\dfrac{5}{2}\)nC2H2= 4,05 mol.
=> V O2 cần dùng = 4,05.22,4 = 90,72 lít

Câu 1:
\(a,PTHH:C_2H_4+5O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(n_{C_2H_4}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(Theo.PTHH:n_{O_2}=5.n_{C_2H_4}=5.0,25=1,25\left(mol\right)\\ V_{O_2\left(đktc\right)}=n.22,4=1,25.22,4=28\left(l\right)\)
\(b,\Rightarrow V_{kk\left(đktc\right)}=5.V_{O_2\left(đktc\right)}=5.28=140\left(l\right)\)
B1:
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
Vì số mol tỉ lệ thuận với thể tích, đồng thời nhìn PTHH, ta sẽ được:
\(a,V_{O_2\left(đktc\right)}=3.V_{C_2H_4\left(đktc\right)}=3.5,6=16,8\left(l\right)\)
\(b,V_{kk}=5.V_{O_2\left(đktc\right)}=16,8.5=84\left(l\right)\)
B2:
Đặt số mol metan, etylen lần lượt là a,b (mol) (a,b>0)
\(n_{hh}=n_{CH_4}+n_{C_2H_4}=a+b=\dfrac{3,36}{22,4}=0,15\left(1\right)\)
PTHH: CH4 +2 O2 -to-> CO2 +2 H2O
C2H4 +3 O2 -to-> 2CO2 + 2H2O
\(n_{CO_2\left(tổng\right)}=a+2b=\dfrac{8,8}{44}=0,2\left(mol\right)\left(2\right)\)
(1), (2) =>a=0,1; b=0,05
Số mol tỉ lệ tương ứng với thể tích. Nên:
\(\%V_{CH_4}=\%n_{CH_4}=\dfrac{0,1}{0,15}.100\approx66,667\%\\ \Rightarrow\%V_{C_2H_4}\approx33,333\%\)

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%
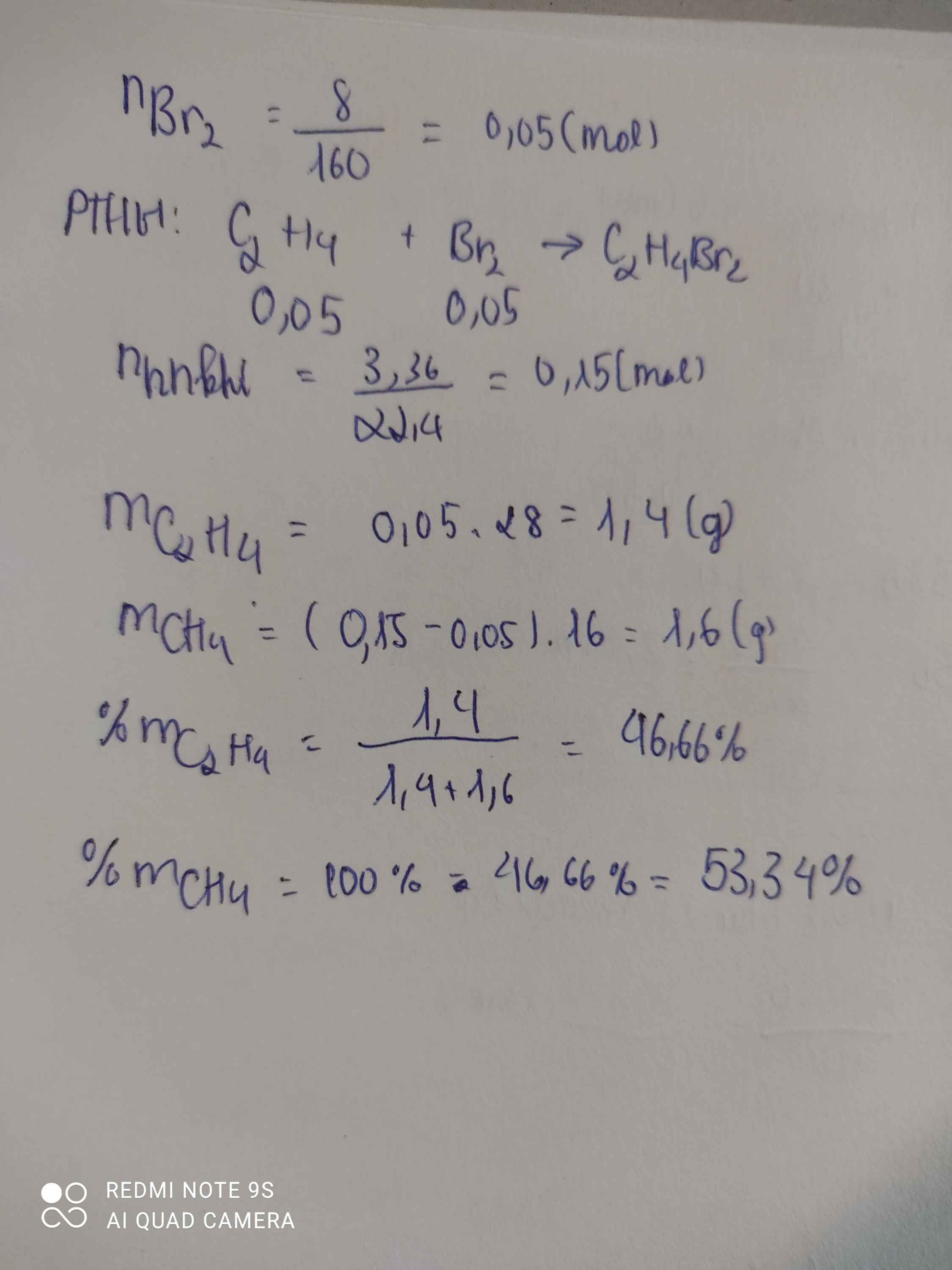
a, \(V_{O_2}=61,6.20\%=12,32\left(l\right)\Rightarrow n_{O_2}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
PT: \(2C_2H_6+7O_2\underrightarrow{t^o}4CO_2+6H_2O\)
\(C_3H_4+4O_2\underrightarrow{t^o}3CO_2+2H_2O\)
Ta có: \(n_{C_2H_6}+n_{C_3H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=\dfrac{7}{2}n_{C_2H_6}+4n_{C_3H_4}=0,55\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_2H_6}=0,1\left(mol\right)\\n_{C_3H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_6}=\dfrac{0,1.22,4}{3,36}.100\%\approx66,67\%\\\%V_{C_3H_4}\approx33,33\%\end{matrix}\right.\)
b, \(C_3H_4+2Br_2\rightarrow C_3H_4Br_4\)
Ta có: \(n_{Br_2}=2n_{C_3H_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Br_2}=0,1.60=16\left(g\right)\Rightarrow m_{ddBr_2}=\dfrac{16}{8\%}=200\left(g\right)\)
Cứu mình với ạ 😭😭. Đang cần gấp