Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=0,1 mol
nO2=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=6,5/65=0,1 mol
n O2=0,8/32=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{1,55}{31}=0,05\left(mol\right)\)
\(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,05}{4}>\dfrac{0,05}{5}\), ta được P dư.
c, Theo PT: \(n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=0,04\left(mol\right)\Rightarrow n_{P\left(dư\right)}=0,05-0,04=0,01\left(mol\right)\)
\(\Rightarrow m_{P\left(dư\right)}=0,01.31=0,31\left(g\right)\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,4}{3}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{3}{4}n_{Al}=0,3\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,3=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,1.22,4=2,24\left(l\right)\)
Lập phương trình hóa học:
Al+O2---->Al2O3
4Al+3O2---->2AlO3
Áp dụng đinh luật bảo toàn khối lượng ta có:
mAl + mO2=mAl2O3
=>mO2=mAl2O3 - mAl
=>mO2=20,4 - 10,8=9,6(g)
Số mol của 9,6g khí oxi là:
ADCT: n=m\M=>nO2=9,6\32=>nO2=0,3(mol)
n=V\22,4=>VO2=nO2 . 22,4=0,3 . 22,4=6,72(l)

a) nFe= 0,25(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
0,25______0,25______0,25__0,25(mol)
b) V(H2,đktc)=0,25.22,4=5,6(l)
c) mH2SO4= 0,25.98= 24,5(g)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)

\(a) 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ n_{Al} = \dfrac{5,4}{27} = 0,2(mol)\\ n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,1(mol) \Rightarrow m_{Al_2O_3} = 0,1.102 = 10,2(gam)\\ b) n_{O_2} = \dfrac{3}{4}n_{Al} = 0,15(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,3(mol) \Rightarrow m_{KMnO_4} = 0,3.158 = 47,4(gam)\)
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
b, Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2.158=47,4\left(g\right)\)
Bạn tham khảo nhé!

a) PTHH: 3Fe + 2O2 =(nhiệt)=> Fe3O4
b) Số mol Fe: nFe = \(\frac{11,2}{56}=0,2\left(mol\right)\)
Số mol O2: nO2 = \(\frac{22,4}{22,4}=1\left(mol\right)\)
c) Lập tỉ lệ : \(\frac{0,2}{3}< \frac{1}{2}\)
=> Fe hết, O2 dư
=> nO2(phản ứng) = \(\frac{0,2.2}{3}=\frac{2}{15}\left(mol\right)\)
=> nO2(dư) = \(1-\frac{2}{15}=\frac{13}{15}\left(mol\right)\)
=> mO2 = \(\frac{13}{15}.32=27,73\left(gam\right)\)
d) nFe3O4 = \(\frac{0,2}{3}=\frac{1}{15}\left(mol\right)\)
=> mFe3O4 = \(\frac{1}{15}.232=15,47\left(gam\right)\)
nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{11,2}{56}=0,2\left(mol\right)\)
\(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{22,4}{22,4}=1\left(mol\right)\)
PTHH: 3Fe + 2O2 -to> Fe3O4
Theo PTHH và đề bài ta có:
\(\frac{n_{Fe\left(đềbài\right)}}{n_{Fe\left(PTHH\right)}}=\frac{0,2}{3}\approx0,067< \frac{n_{O\left(đềbài\right)}}{n_{O_2\left(PTHH\right)}}=\frac{1}{2}=0,5\)
=> Fe đã phản ứng hết và O2 dư nên tính theo nFe.
c) \(n_{O_2\left(phảnứng\right)}=\frac{2}{3}.n_{Fe}=\frac{2}{3}.0,2=0,133\left(mol\right)\)
\(n_{O_2\left(dư\right)}=n_{O_2\left(banđầu\right)}-n_{O_2\left(phảnứng\right)}=0,5-0,133=0,367\left(mol\right)\)
=> \(m_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.M_{O_2}=0,367.32\approx11,744\left(g\right)\)
d) Theo PTHH và đề bài, ta có:
\(n_{Fe_3O_4}=\frac{1}{3}.n_{Fe}=\frac{1}{3}.0,2\approx0,067\left(mol\right)\)
=> \(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,067.232=15,544\left(g\right)\)

\(2H2 + O2 -t^o-> 2H2O\)
\(n_H2 = \) \(\dfrac {11,2}{22,4} \) \(=\) \(0,5 (mol)\)
\(=>\) \(n_O2 = \dfrac{1} {2} . n_H2 = 0,25 ( mol)\)
\(=> V_O2 (đktc) = 0,25 . 22,4 = 5,6 (l)\)
\(=> V_K2= 5.V_O2\) = \(5.5,6 = 28 (l)\)
\(b) \)
\(Zn +2HCl ---> ZnCl2 + H2\)
\(nZn = nH2 = 0,5 (mol)\)
Khối lượng Kẽm cần dùng là :
\(=> mZn = 0,5.65 = 32,5 (g)\)

Bài 4 câu a đề là thể tích H2 nha bạn
a)\(Fe2O3+3H2-->2Fe+3H2O\)
\(n_{Fe2O3}=\frac{12}{160}=0,075\left(mol\right)\)
\(n_{H2}=3n_{Fe2O3}=0,225\left(mol\right)\)
\(V_{H2}=0,225.22,4=5,04\left(l\right)\)
b)\(n_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
Bài 6
a)\(Zn+H2SO4-->ZnSO4+H2\)
\(n_{Zn}=\frac{19,5}{65}=0,3\left(mol\right)\)
\(n_{ZnSO4}=n_{Zn}=0,3\left(mol\right)\)
\(m_{ZnSO4}=0,3.162=48,3\left(g\right)\)
b)\(n_{H2}=n_{Zn}=0,3\left(mol\right)\)
\(V_{H2}=0,3.22,4=6,72\left(l\right)\)
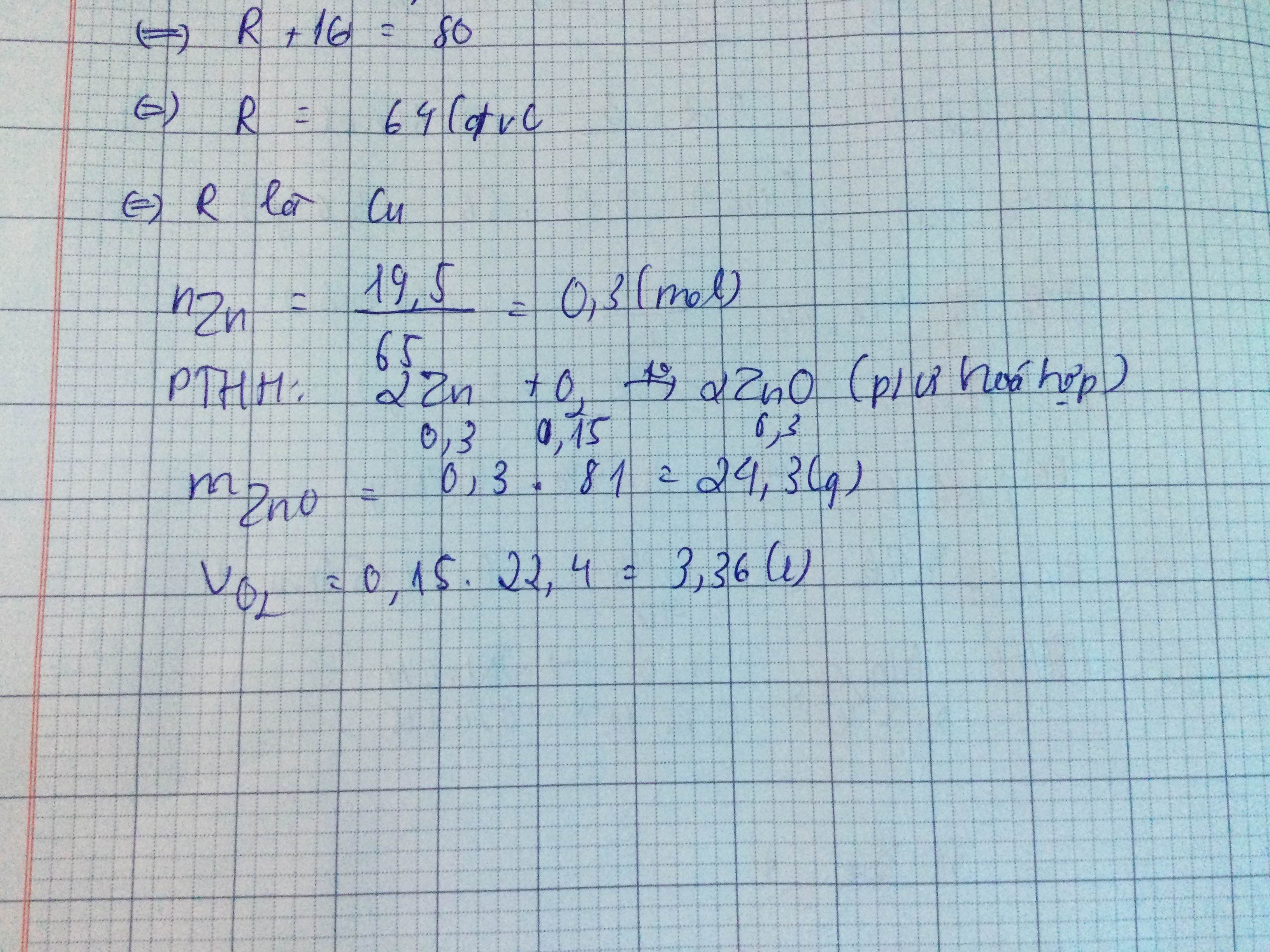
a)\(4Na+O2-->2Na2O\)
\(n_{Na}=\frac{18,4}{23}=0,8\left(mol\right)\)
\(n_{O2}=\frac{1}{4}n_{Na}=0,2\left(mol\right)\)
\(V_{O2}=0,2.22,4=4,48\left(l\right)\)
b)\(n_{Na2O}=\frac{1}{2}n_{Na}=0,4\left(mol\right)\)
\(m_{Na2O}=0,4.62=24,8\left(g\right)\)
c)\(2KMnO4-->K2MnO4+MnO2+O2\)
\(4Na+O2-->2Na2O\)
\(n_{KMnO4}=\frac{142,2}{158}=0,9\left(mol\right)\)
\(n_{O2}=\frac{1}{2}n_{KMnO4}=0,45\left(mol\right)\)
\(n_{Na}=\frac{18,4}{23}=0,8\left(mol\right)\)
Lập tỉ lệ
\(nNa\left(\frac{0,8}{4}\right)< n_{O2}\left(\frac{0,45}{1}\right)\)
=> O2 dư
\(n_{O2}=\frac{1}{4}n_{Na}=0,2\left(mol\right)\)
\(n_{_{ }O2}dư=0,45-0,2=0,25\left(mol\right)\)
\(m_{O2}dư=0,25.32=8\left(g\right)\)