Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mFe=3,36 g; mAl=2,7 g; mAg=4,32 g
Giải thích các bước giải:
Gọi số mol Fe, Al, Ag trong mỗi phần là x, y, z.
P1: có Fe, Al phản ứng
nH2=0,105 mol; nSO2=0,13 mol
PTHH:
Fe+H2SO4→FeSO4+H2
2Al+3H2SO4→Al2(SO4)3+3H2
⇒x+3y/2=0,105 (1)
P2:
2Fe+6H2SO4→3SO2+Fe2(SO4)3+6H2O2
2Al+6H2SO4→3SO2+Al2(SO4)3+6H2O
2Ag+2H2SO4→SO2+Ag2SO4+2H2O
⇒3x/2+3y/2+z/2=0,13 (2)
mà 56x+27y+108z=10,38:2 (3)
Từ (1),(2),(3) ⇒x=0,03; y=0,05; z=0,02 mol
Khi đó: mFe=2.56.0,03=3,36 g; mAl=2.27.0,05=2,7 g
mAg=2.108.0,02=4,32 g
Vì phần 1 tác dụng với H2SO4 loãng => sinh ra khí H2
=> n H2 = 0,105 ( mol )
Có: n SO2 = 0,13 ( mol )
Gọi n Fe, n AL, n Ag ở mỗi phần lần lượt là a, b, c
Vì m Fe + m Al + m Ag = 10,38
=> 56a + 27b + 108c = 10,38 : 2 = 5,19 ( 1 )
PTHH của phần 1
Fe + H2SO4 ====> FeSO4 + H2
2Al + 3H2SO4 =====> Al2(SO4)3 + 3H2
theo pthh: a+ 1,5b = 0,105 ( mol ) ( 2 )
PTHH của phần 2
2Fe + 6H2SO4 =====> Fe2(SO4)3 + 3SO2 + 6H2O
2AL + 6H2SO4 ===> Al2(SO4)3 + 3SO2 + 6H2O
2Ag + 2H2SO4 =====> Ag2SO4 + SO2 + 2H2O
theo PTHH: 1,5a + 1,5b + 0,5c = 0,13 ( 3 )
từ ( 1 ) , (2) và (3) suy ra
a = 0,03 ( mol ) => m Fe = 3,36 ( g )
b = 0,05 ( mol ) => m Al = 2,7 ( g )
c = 0,02 ( mol ) => m Ag = 4,32 ( g )

a)
Gọi số mol Fe, Al, Ag trong mỗi phần là a, b,c (mol)
=> 56a + 27b + 108c = 5,19 (1)
Phần 1:
\(n_{H_2}=\dfrac{2,352}{22,4}=0,105\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a----->a------------------>a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b------>1,5b------------------->1,5b
=> a + 1,5b = 0,105 (2)
Phần 2:
\(n_{SO_2}=\dfrac{2,912}{22,4}=0,13\left(mol\right)\)
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
b----->3b-------------------->1,5b
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
a------>3a--------------------->1,5a
2Ag + 2H2SO4 --> Ag2SO4 + SO2 + 2H2O
c-------->c------------------>0,5c
=> 1,5a + 1,5b + 0,5c = 0,13 (3)
(1)(2)(3) => a = 0,03 (mol); b = 0,05 (mol); c = 0,02 (mol)
=> \(\left\{{}\begin{matrix}m_{Fe}=2.0,03.56=3,36\left(g\right)\\m_{Al}=2.0,05.27=2,7\left(g\right)\\m_{Ag}=2.0,02.108=4,32\left(g\right)\end{matrix}\right.\)
b)
- Phần 1:
\(n_{H_2SO_4}=a+1,5b=0,105\left(mol\right)\)
- Phần 2:
\(n_{H_2SO_4}=3a+3b+c=0,26\left(mol\right)\)

Gọi a, b, c, d là mol mỗi chất trong 32g X
Bảo toàn e: (1)
Bảo toàn e: (2)
Lấy (2) trừ (1) =>
Gọi a, b, c, d là mol mỗi chất trong 32g X
Bảo toàn e: (1)
Bảo toàn e: (2)
Lấy (2) trừ (1) =>

MX= 19.2=38
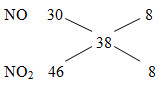
=> nN2=nNO2=x
mFe + mO = moxit
=> mO = moxit- mFe = 7,36-5,6=1,76 gam
=> nO = 0,11 mol
Fe0 →Fe3+ + 3e
0,1 0,3
O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4
0,11 0,22 3x x x x
Bảo toàn e: 0,3 = 0,22+3x+x =0,22+4x =>x= 0,02
=> nkhí = 2x=0,04 mol
=> Vkhí = 0,04.22,4=0,896 lít=896 ml

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
=> \(n_{H_2SO_4}=0,2\left(mol\right)\)
mmuối = mkim loại + mSO4 = 12 + 0,2.96 = 31,2 (g)
BT O: \(n_O=\dfrac{7,2-5,6}{16}=0,1\left(mol\right)\)
=> \(n_X=n_O=0,1\left(mol\right)\)
\(Fe^o\rightarrow Fe^{3+}+3e\)
0,1 0,3
\(S^{+6}+2e\rightarrow S^{+4}\)
0,3 0,15
BT e: \(n_{SO_2}=\dfrac{0,3}{2}=0,15\Rightarrow V_{SO_2}=3,36\left(l\right)\)