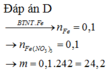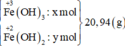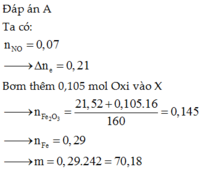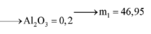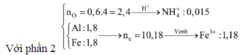Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64%

Đáp án A
Quy đổi rắn X thành hỗn hợp ban đầu gồm Fe và O
Gọi x, y, z lần lượt là số mol Fe3+, Fe2+ và số mol O
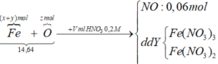
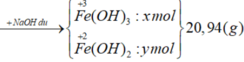
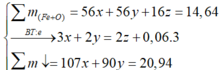
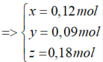
Bảo toàn nguyên tố N:
nHNO3 = nNO3- (trong muối) + nNO
= (3.0,12 + 2.0,09) + 0,06 = 0,3 (mol)
=> VHNO3 = n : CM = 0,3: 0,2 = 3 (lít)

Quy đổi rắn X thành hỗn hợp ban đầu gồm Fe và O
Gọi x, y, z lần lượt là số mol Fe3+, Fe2+ và số mol O

Bảo toàn nguyên tố N:
nHNO3 = nNO3- (trong muối) + nNO
= (3.0,12 + 2.0,09) + 0,06 = 0,3 (mol)
=> VHNO3 = n : CM = 0,3: 0,2 = 3 (lít)
Đáp án A

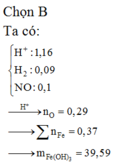
Đáp án B
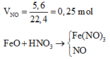
Quá trình cho nhận electron:
Fe+2 → Fe+3 + 1e N+5 + 3e → N+2
0,75 ← 0,75 0,75 ← 0,25
m F e O = 0,75.72 = 36 gam

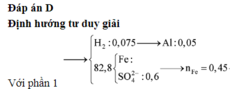
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D