Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vậy O 2 dư.
Sau phản ứng Na không dư nên không có khí H 2 bay ra, quỳ tím chuyển sang màu xanh vì:
N a 2 O + H 2 O → 2 N a O H

\(n_{Al}=\dfrac{10,8}{27}=0,4mol\)
\(n_{HCl}=\dfrac{49}{36,5}=1,34mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Xét: \(\dfrac{0,4}{2}\) < \(\dfrac{1,34}{6}\) ( mol )
0,4 1,2 0,4 0,6 ( mol )
\(V_{H_2}=0,6.22,4=13,44l\)
\(m_{AlCl_3}=0,4.133,5=53,4g\)
\(m_{HCl\left(dư\right)}=\left(1,34-1,2\right).36,5=5,11g\)
Nhúng quỳ tím vào dung dịch sau phản ứng thấy quỳ tím hóa đỏ, vì sau phản ứng dd HCl còn dư.

a) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\); \(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{0,5}{1}\) => Fe hết, H2SO4 dư
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,4--->0,4-------->0,4--->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b) Do trong dd sau pư có H2SO4 dư nên dd làm quỳ tím chuyển màu đỏ
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\ n_{H_2SO_{\text{ 4 }}}=\dfrac{49}{98}=0,5\left(mol\right)\\ pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
LTL: 0,4<0,5 => Fe hết H2SO4 dư
theo pthh : nH2 = nFe =0,4(mol)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
dd là muối => nhưng có H2SO4 dư nên qt CHUYỂN đỏa

a, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{200}{18}=\dfrac{100}{9}\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{\dfrac{100}{9}}{2}\), ta được H2O dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,05\left(mol\right)\Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
b, Theo PT: \(n_{NaOH}=n_{Na}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 2,3 + 100 - 0,05.2 = 102,2 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,1.40}{102,2}.100\%\approx3,91\%\)
c, - Dung dịch làm quỳ tím hóa xanh.
\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\\ 2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right);n_{NaOH}=n_{Na}=0,1\left(mol\right)\\ a,V=V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,m_{ddNaOH}=m_{Na}+m_{H_2O}-m_{H_2}=2,3+200-0,05.2=202,2\left(g\right)\\ C\%_{ddNaOH}=\dfrac{40.0,1}{202,2}.100\approx1,978\%\\ c,NaOH-Tính.bazo\Rightarrow Quỳ.tím.hoá.xanh\)

a) Na nóng chảy, chạy trên mặt nước, tan dần và có khí không màu thoát ra
PTHH: 2Na + 2H2O --> 2NaOH + H2 (pư oxi hóa-khử)
b) Sau pư, thu được dd bazo nên quỳ tím chuyển màu xanh
c) \(n_{H_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,5<----------------0,5<---0,25
=> mNa = 0,5.23 = 11,5 (g)
d) Sản phẩm tạo thành là NaOH (sodium hydroxide) và H2(hydrogen)
mNaOH = 0,5.40 = 20 (g)
mH2 = 0,25.2 = 0,5 (g)

`Na+H_2O\rightarrowNaOH+1/2H_2`
Dung dịch thu được sau phản ứng là NaOH
=> quỳ tím chuyển màu xanh

2Na+2H2O->2NaOH+H2
0,2-----0,2----0,2----------0,1
n Na=0,2 mol
=>Quỳ chuyển màu xanh
VH2=0,1.22,4=2,24l
2Na+2H2O->2NaOH+H2
n H2O=0,4 mol
=>H2O dư
=>m dư=0,2.18=3,6g
a) QT chuyển xanh
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\\
pthh:Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,2 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\\
n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\\
LTL:\dfrac{0,2}{1}< \dfrac{0,4}{1}\)
=> H2O dư
\(n_{H_2O\left(p\text{ư}\right)}=n_{Na}=0,2\left(mol\right)\\
m_{H_2O\left(d\right)}=\left(0,4-0,2\right).18=3,6\left(g\right)\)
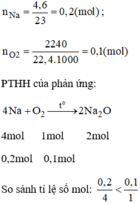
Ta có:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{2240}{22400}=0,1\left(mol\right)\)
Phương trình hóa học của phản ứng:
\(4Na+O_2\rightarrow2Na_2O\)
Lập tỷ số: \(\dfrac{0,2}{4}=0,05< \dfrac{0,1}{1}\rightarrow\) Vậy \(O_2\)dư, sau phản ứng không còn Na dư nên không có khí hidro bay ra, quỳ tím chuyển thành màu xanh do\(Na_2O+H_2O\rightarrow2NaOH\)
p/s: tl góp vui :v