Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đáp án A
- Do HNO3 là chất điện li mạnh nên nó phân li hoàn toàn trong dung dịch
HNO3 → H+ + NO3-
0,1 0,1 0,1 (M)
⇒ [H+ ] = [NO3- ] = 0,1M

- Đáp án D
- Do CH3COOH là chất điện li yếu nên trong nước chỉ phân li một phần
CH3COOH ⇌ H+ + CH3COO-
Vì vậy [H+] < [CH3COO-]= 0,1M

Axit mạnh HNO3 phân ly hoàn toàn : HNO3 == > H+ + NO3-, [H+] = 0,1 M
Axit yếu HNO2 phân ly không hoàn toàn HNO2 < == > H+ + NO2-, [H+] < 0,1 M
[H+]HNO3 > [H+]HNO2
đối với dung dịch axit mạnh HNO3 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
Axit mạnh \(HNO_3\) phân ly hoàn toàn : \(HNO_3\) \(\Rightarrow H++NO_3-,\left[H+\right]=0,1M\)

đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
Đánh giá đúng [H+] < 0,10M vì Axit yếu CH3COOH phân ly không hoàn toàn CH3COOH <=> CH3COO- + H+ [H+] < 0,1 M
đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
Đánh giá đúng \(\left[H+\right]< 0,10M\) vì Axit yếu \(CH_3COOH\) phân ly không hoàn toàn \(CH_3COOH\) \(\Leftrightarrow CH_3COOH-+H+\left[H+\right]< 0,1M\)
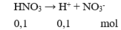
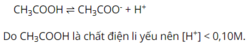
Chọn A. [H+] = 0.10M.
Ta có phương trình điện li :
HNO3HNO3 →→ H++NO−3H++NO3−
0,10M →→ [H+H+] = [NO−3NO3−] = 0,10M
Chọn A.
bạn còn muốn xem bài nào thì truy cập link này nha. https://cunghocvui.com/bai-viet/bai-5-trang-10-sach-giao-khoa-hoa-11.html