Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
xem dung dịch Y: bảo toàn 0,15 mol anion NO3–; Fe + Y → hỗn hợp kim loại + khí NO
||→ Y chứa cation Ag+ và H+. Quan sát sơ đồ bài tập HNO3:
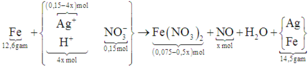
BTKL kim loại: 12,6 + 108 × (0,15 – 4x) = 56 × (0,075 – ½.x) + 14,5 ||→ x = 0,025 mol.
||→ ne trao đổi = nH+ sinh ra = 4z = 0,1 mol ||→ thời gian t = 96500 × 0,1 ÷ 2,68 = 3600 (s) ⇄ 1 giờ.
||→ theo đó đáp án cần chọn là C.

Chọn đáp án D.
Đặt số mol của CuSO4 là a, của NaCl là 3a.
Phương trình điện phân:

Sau khi điện phân t giờ, dung dịch Y chứa 2 chất tan là Na2SO4 và NaOH => Cu2+, Cl- đều bị điện phân hết.
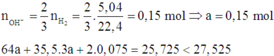
=> Chứng tỏ đã xảy ra điện phân nước.


Đáp án C
ne = 0,15 mol
dd X sau điện phân tác dụng với Fe tạo khí NO nên X phải chứa H+ nên
Tại A(+) : có 2Cl- → Cl2 + 2e
2H2O → 4H+ + 4e + O2
Tại K (-) thì : Cu2+ + 2e → Cu
Dd sau phản ứng đem cho Fe vào thì :
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,09 mol ← 0,0225 mol
Nếu Cu không có trong dd thì khối lượng rắn còn lại sau phản ứng là 0,125.56-0,0225.3:2.56 =5,11 < 5,43
→Cu còn trong dd và xảy ra phản ứng
Cu2+ + Fe → Cu + Fe2+
→ mrắn = 0,125.56 – 0,0225.3 : 2.56 + 8nCu2+(X) → nCu2+(X) = 0,04 mol
Vì Cu2+ còn dư trong X nên phản ứng tại (K) chỉ có Cu2+ với lượng phản ứng là 0,15 :2 =0,075 mol
Bảo toàn Cu có x = 0,075 + 0,04 =0,115 mol
Tại (A) thì ne = nCl + nH+ → 0,15 = nCl + 0,09 → nCl = 0,06 mol
Bảo toàn Cl có y =0,06 mol
→ x : y =0,115 : 0,06 =1,917
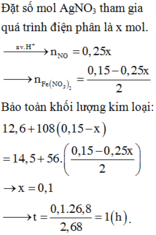


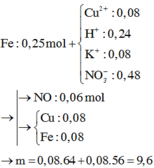
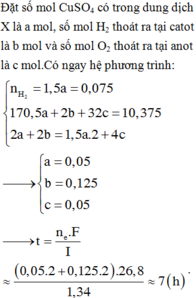


Đáp án B
4AgNO3 + 2H2O → d p 4Ag + 4HNO3 + O2
Dung dịch sau điện phân chứa AgNO3 dư = 0,3–x và HNO3 = x mol
Thấy mAg tối đa = 0,3 × 108 = 32,4 < 34,28g → chứng tỏ chất rắn chứa Ag :0,3-x và Fe dư :y
Có nNO = nHNO3 ÷ 4 = 0,25x mol
Bảo toàn electron → 2nFe pư = 3nNO + nAg.
⇒ nFe pư = ( 3×0,25x + 0,3-x) : 2 = 0,15-0,125x
→ 108×(0,3-x) + 22,4 – 56×(0,15-0,125x) = 34,28 ⇒ x = 0,12 mol
⇒ Thời gian điện phân t = 0 , 12 × 96500 2 , 68 × 3600 = 1,2 giờ