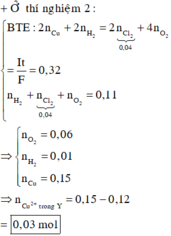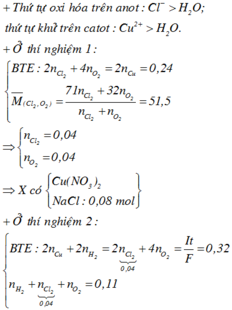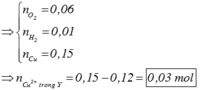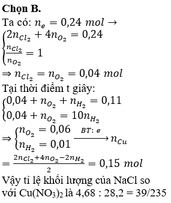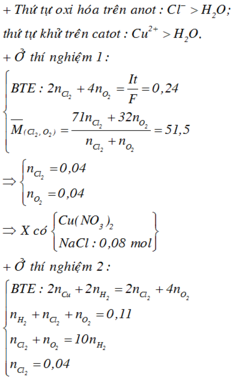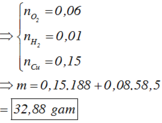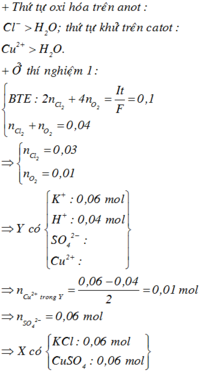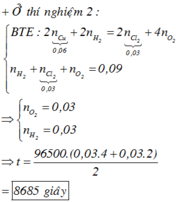Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
☆ Xét thời gian điện phân là t giây:
Từ tỉ khối khí bên anot so với với H2 → gồm O2 và Cl2 với số mol bằng nhau.
dung dịch Y vẫn còn màu xanh chứng tỏ vẫn dư Cu2+ trong Y.
⇒ 7,68 gam kim loại thu được là 0,12 mol Cu → ∑ne trao đổi = 0,12 × 2 = 0,24 mol.
⇒ 4nO2 + 2nCl2 = 0,24 ⇒ nO2 = nCl2 = 0,04 mol.
☆ xét thời gian điện phân là 12352 giây
→ Áp dụng công thức định luật Farađay có ∑ne trao đổi = It ÷ 96500 = 0,32 mol.
Bên anot: ra hết Cl2 là 0,04 mol ⇒ nO2 = (0,32 – 0,04 × 2) ÷ 4 = 0,06 mol.
Mà giả thiết ∑nkhí 2 cực = 0,11 mol ⇒ nH2 bên catot = 0,01 mol.
Catot thu được H2 chứng tỏ Cu2+ bị điện phân hết ⇒ ∑nCu2+ = (0,32 – 0,01 × 2) ÷ 2 = 0,15 mol.
Quay lại thời gian sau điện phân t giây, nCu2+ trong Y = 0,15 – 0,12 = 0,03 mol

Đáp án B
☆ Xét thời gian điện phân là t giây:
Từ tỉ khối khí bên anot so với với H2 → gồm O2 và Cl2 với số mol bằng nhau.
dung dịch Y vẫn còn màu xanh chứng tỏ vẫn dư Cu2+ trong Y.
⇒ 7,68 gam kim loại thu được là 0,12 mol Cu → ∑ne trao đổi = 0,12 × 2 = 0,24 mol.
⇒ 4nO2 + 2nCl2 = 0,24 ⇒ nO2 = nCl2 = 0,04 mol.
☆ xét thời gian điện phân là 12352 giây
→ Áp dụng công thức định luật Farađay có ∑ne trao đổi = It ÷ 96500 = 0,32 mol.
Bên anot: ra hết Cl2 là 0,04 mol ⇒ nO2 = (0,32 – 0,04 × 2) ÷ 4 = 0,06 mol.
Mà giả thiết ∑nkhí 2 cực = 0,11 mol ⇒ nH2 bên catot = 0,01 mol.
Catot thu được H2 chứng tỏ Cu2+ bị điện phân hết ⇒ ∑nCu2+ = (0,32 – 0,01 × 2) ÷ 2 = 0,15 mol.
Quay lại thời gian sau điện phân t giây, nCu2+ trong Y = 0,15 – 0,12 = 0,03 mol

Đáp án B
Khi điện phân trong 9264 giây thì
n
e
=
I
t
/
F
=
0
,
24
m
o
l
, lúc này: 
![]()
Mà m k h í = 71 u + 32 v = 25 , 75 . 2 u + v → u = v = 0 , 04
Khi điện phân t giây:
![]()
![]()
Þ Tổng mol khí = b + c + 0,04 = 0,11.
Bảo toàn electron: 2a + 2b = 0,04.2 + 4c
Và 0,04 + c = 10b
Þ a = 0,15; b = 0,01; c = 0,06
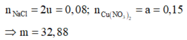

Đáp án C

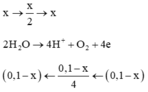
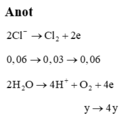

Số mol khí là:
0 , 03 + y + 2 y - 0 , 03 = 0 , 09 ⇒ y = 0 , 03 ⇒ n e = 0 , 18 ⇒ t = 8685 s