Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D.
Sau khi điện phân thu được hỗn hợp kim loại => Fe3+, Cu2+ bị điện phân hết, Fe2+ đã bị điện phân.
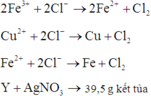
=> Chứng tỏ Y chứa FeCl2 dư.
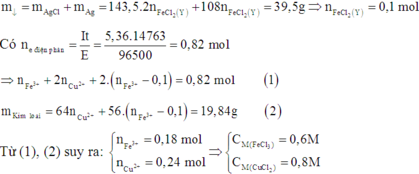

Đáp án D
- Xét trường hợp dung dịch Y chứa chất tan là NaOH và NaCl. Quá trình điện phân diễn ra như sau:
| Tại catot: Fe2+ + 2e → Fe x ← 2x → x 2H2O + 2e → 2OH- + H2 2y → 2y y |
Tại Anot: 2Cl- → Cl2 + 2e (2x + 2y) (x + y) ← (2x + 2y) |
- Từ phương trình:
Al + 3 H 2 O + NaOH → Na [ Al ( OH ) 4 ] + 3 2 H 2
suy ra
![]()
- Khối lượng dung dịch giảm:
![]()
- Hỗn hợp X:
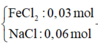
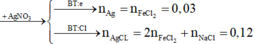
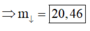

Đáp án D
Đặt nNO = x; nN2O = y ⇒ nZ = x + y = 0,005 mol; mZ = 30x + 44y = 0,005 × 19,2 × 2.
||⇒ giải hệ có: x = 0,002 mol; y = 0,003 mol || nMg dư = nH2 = 0,005 mol
⇒ nAg = (0,336 – 0,005 × 24) ÷ 108 = 0,002 mol. Đặt nMg phản ứng = a. Bảo toàn electron:
2nMg phản ứng = 3nNO + 8nN2O + 8nNH4NO3 + nAg ⇒ nNH4NO3 = (0,25a – 0,004) mol
||⇒ mmuối = 148a + 80.(0,25a – 0,004) = 3,04(g) ⇒ a = 0,02 mol. Lại có:
ne = nH+ = nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol ⇒ t = 2316(s)

Đáp án D
Vì Mg + dung dịch X → N2O và NO ⇒ X có chứa HNO3.
+ Nhận thấy 0,036 gam hỗn hợp kim loại chính là Ag và Mg.
⇒ X chứa AgNO3 dư và nMg dư = 0,005 mol ⇒ nAg = 0,002 mol
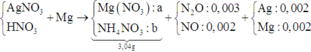
+ PT theo bảo toàn e ta có: 2nMg = nAg + 8nNH4+ + 8nN2O + 3nNO.
<=> 2a – 8b = 0,032 (1).
+ PT theo khối lượng muối: 148a + 80b = 3,04 (2).
+ Giải hệ (1) và (2) ⇒ nMg pứ = 0,02 và nNH4NO3 = 0,001.
⇒ Bảo toàn nitơ ta có nHNO3/X = 0,048 mol.
⇒ t = 0,048 × 96500 ÷ 2 = 2316s


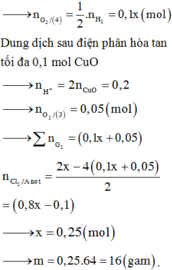


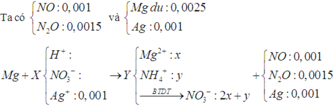
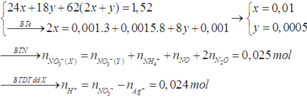
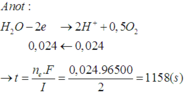
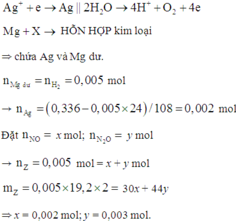
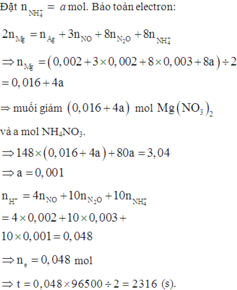
Chọn đáp án A