Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Dung dịch X bị điện phân đến khi xuất hiện bọt khí ở catot thì dừng ⇒ Cu2+ đã điện phân hết và catot chỉ còn H+ ⇒ Y chỉ chứa HNO3, còn 2 khí có số mol 0,44 mol tại anot là Cl2 và O2


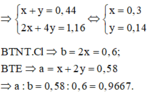

Đáp án B
Khi điện phân trong 9264 giây thì
n
e
=
I
t
/
F
=
0
,
24
m
o
l
, lúc này: 
![]()
Mà m k h í = 71 u + 32 v = 25 , 75 . 2 u + v → u = v = 0 , 04
Khi điện phân t giây:
![]()
![]()
Þ Tổng mol khí = b + c + 0,04 = 0,11.
Bảo toàn electron: 2a + 2b = 0,04.2 + 4c
Và 0,04 + c = 10b
Þ a = 0,15; b = 0,01; c = 0,06
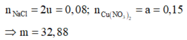

Đáp án A
![]()
Tại anot thoát ra 0,2 mol khí gồm Cl2 và O2 với số mol đều là 0,1 mol.
Cho 20 gam Fe vào dung dịch sau điện phân được 12,4 gam hai kim loại chứng tỏ Fe dư và trong dung dịch sau điện phân còn Cu2+.


Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b
=> a+b=0,12
Bảo toàn e: n e = 2 a + 4 b
Lúc 2t giây: n e = 4 a + 8 b
Lúc này ở anot thu được Cl2 a mol và O2 → n O 2 = 4 a + 8 b - 2 a 4 = 0 , 5 a + 2 b
Do vậy ở catot thu được là H2 với số mol H2 = 0 , 5 a + 2 b + a 3 = 0 , 5 a + 2 b 3
Bảo toàn e:
n C u 2 + = 2 a + 4 ( 0 , 5 a + 2 b ) - 2 ( 0 , 5 a + 2 b 3 ) 2 = 1 , 5 a + 10 b 3 → 64 ( 1 , 5 a + 10 b 3 ) = 18 , 56
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.

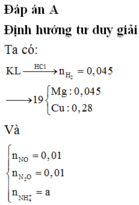
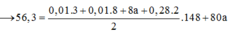
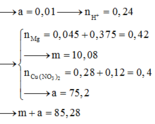
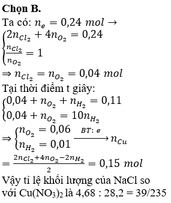
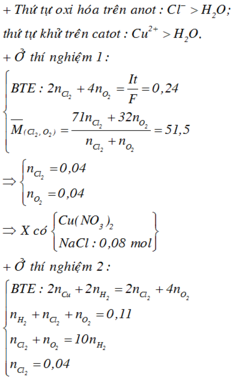
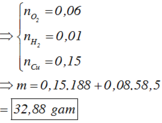

Mhh = 25,75.2 = 51,5 → n(Cl2) = n(O2)
n(Cl2) + n(O2) = 0,02 → n(Cl2) = n(O2) = 0,01
ne = 2nCu = 2n(Cl2) + 4n(O2) → nCu = 0,01 + 0,01.2 = 0,03
→ mCu = 0,03.64 = 1,92 (g)
→ Đáp án C