Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Do tại 3 thời điểm khối lượng catot đều tăng nên Cu2+ điệp phân chưa hết ở t1 và t2
*Tại t1 = 1930 giây: ne1 = It1/F = 0,02I
=> nCl2 = 0,01I
n e1 = 2nCu2+ bị đp => 0,02I = 2m/64 (1)
m dung dịch giảm = mCu + mCl2 => 2,7 = m + 71.0,01I (2)
Giải (1) và (2) => m = 1,28; I = 2
*Tại t2 = 7720 => ne2 = 0,16 mol
Anot:
Cl- -1e → 0,5Cl2
x 0,5x
H2O -2e → 0,5O2 + 2H+
y 0,25y
x+y = 0,16
0,5x.71+0,25y.32+4.1,28 = 9,15
Giải ra ta được x = 0,1; y = 0,06
*Tại t3 = t: Giả sử nước bị điện phân ở cả 2 điện cực
nH2 = a mol, nO2 = b mol
m dung dịch giảm = mCu + mH2 + mCl2 +mO2 => 11,11 = 5.1,28 + 2a + 0,05.71 + 32b (3)
n e anot = ne catot => 2nCu + 2nH2 = 2nCl2 + 4nO2 => 2.0,1 + 2a = 0,05.2 + 4b (4)
Giải (3) và (4) thu được: a = 0,02; b = 0,035
n e3 = 2.0,1 + 2.0,02 = 0,24 mol => t = 0,24.96500/2 = 11580 giây

Chọn A.
Tại t1 = 965s
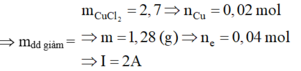
Tại t2 = 3860s Þ ne = 0,16 mol Þ có khí Cl2 (x mol) và O2 (y mol).
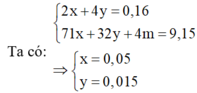
Tại t3 (s) Þ 5m = 6,4 = mCu Þ Ở catot có khí H2 (a mol) và ở anot có khí Cl2 (0,05 mol); O2 (b mol)
mà mdd giảm = 11,11 = 6,4 + 0,05.71 + 2a + 32b (1) và 2a + 0,1.2 = 4b + 0,05.2 (2)
Giải hệ (1), (2) suy ra: a = 0,02 ; b = 0,035 Þ ne = 0,24 mol Þ t3 = 11580s. Vậy t3 : t1 = 12.

∑ne trao đổi = 0,3 mol < 2nCu2+.
⇒ Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2
⇒ Quy đổi mDung dịch giảm = mCuCl2 = 0,15×135 = 20,25 ≠ 14,75 ⇒ Loại.
+ Vậy có cả O2 thoát ra
⇒ mDung dịch giảm = mCuCl2 + mCuO.
+ Đặt số mol 2 chất lần lượt là a và b ta có:
a + b = 0,15 mol (PT bảo toàn Cu).
135a + 80b = 14,75 (PT theo m dung dịch giảm).
+ Giải hệ ⇒ a = nCuCl2 = 0,05 mol
⇒ nNaCl = 0,05×2 = 0,1 mol.
⇒ CM NaCl = 0 , 1 0 , 2 = 0,5M
Đáp án D

Đáp án D
∑ne trao đổi = 0,3 mol < 2nCu2+.
⇒ Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2 ⇒ Quy đổi mDung dịch giảm = mCuCl2 = 0,15×135 = 20,25 ≠ 14,75 ⇒ Loại.
+ Vậy có cả O2 thoát ra ⇒ mDung dịch giảm = mCuCl2 + mCuO.
+ Đặt số mol 2 chất lần lượt là a và b ta có:
a + b = 0,15 mol (PT bảo toàn Cu).
135a + 80b = 14,75 (PT theo m dung dịch giảm).
+ Giải hệ ⇒ a = nCuCl2 = 0,05 mol ⇒ nNaCl = 0,05×2 = 0,1 mol.
⇒ CM NaCl = 0,1/0,2 = 0,5M
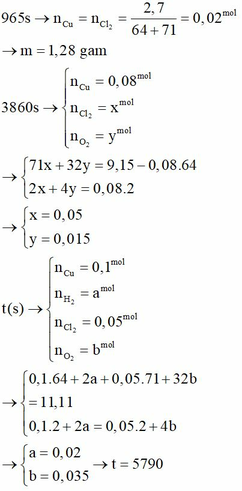
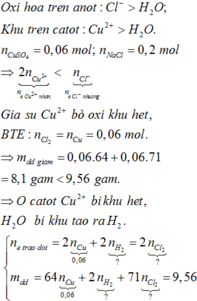
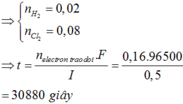
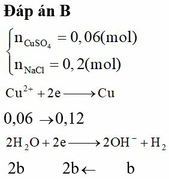
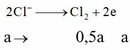
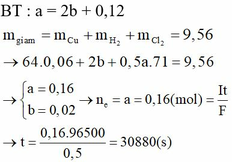




Chọn C
Do tại 3 thời điểm khối lượng catot đều tăng nên Cu2+ điệp phân chưa hết ở t1 và t2
∙Tại t1 = 1930 giây: ne1 = It1/F = 0,02I
=> nCl2 = 0,01I
n e1 = 2nCu2+ bị đp => 0,02I = 2m/64 1
m dung dịch giảm = mCu + mCl2 => 2,7 = m + 71.0,01I 2
Giải 1 và 2 => m = 1,28; I = 2
∙Tại t2 = 7720 => ne2 = 0,16 mol
Anot:
Cl- -1e → 0,5Cl2
x 0,5x
H2O -2e → 0,5O2 + 2H+
y 0,25y
x+y = 0,16
0,5x.71+0,25y.32+4.1,28 = 9,15
Giải ra ta được x = 0,1; y = 0,06
∙Tại t3 = t: Giả sử nước bị điện phân ở cả 2 điện cực
nH2 = a mol, nO2 = b mol
m dung dịch giảm = mCu + mH2 + mCl2 +mO2 => 11,11 = 5.1,28 + 2a + 0,05.71 + 32b 3
n e anot = ne catot => 2nCu + 2nH2 = 2nCl2 + 4nO2 => 2.0,1 + 2a = 0,05.2 + 4b 4
Giải 3 và 4 thu được: a = 0,02; b = 0,035
n e3 = 2.0,1 + 2.0,02 = 0,24 mol => t = 0,24.96500/2 = 11580 giây