Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D.
Dung dịch X chứa HNO3
Þ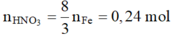 (trường hợp tạo Fe2+)
(trường hợp tạo Fe2+)
Þ AgNO3: 0,16 mol
Tại thời điểm t (s) thu được Ag là x mol Þ ne (1) = x và a = 108x + 0,25x.32 (1)
Tại thời điểm 2t (s) thu được: Ag (0,16 mol) ![]() và
và 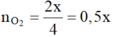
Þ a + 5,36 = 0,16.108 + (2x – 0,16) + 32.0,5x
Từ (1), (2) suy ra: x = 0,12 Þ t = 5790 (s).

Đáp án C
Ta có n N a C l = 0 , 18 mol
Trong thời gian t giây ở anot thu được 0,15 mol khí trong đó có 0,09 mol Cl2 và còn lại là O2 0,06 mol.
→ n e = 0,09.2 + 0,06.4 = 0,42 mol
Khi thời gian điện phân là 2 t giây → n e = 0.84 mol
Vậy ở anot thu đươc 0,09 mol Cl2 và 0,165 mol O2.
Vậy ở catot thu được H2 0,17 mol.
Bảo toàn e:

= n M S O 4 . 5 H 2 O
Vậy M là Ni (59).
Tại thời gian t giây ta thu được ở catot là 0,21 mol Ni => m = 12,39 gam

Đáp án A
Theo định luật Faraday: m = AIt/nF => I = mnF/At : 80% = 3,75 (A)

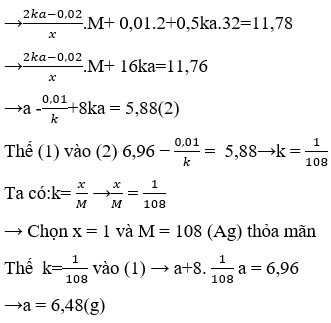
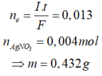
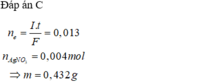

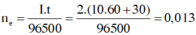
Đáp án B
Theo định luật II của Pha – ra – đây thì khối lượng Ag sinh ra ở catot là:
m = 1 F . A n . It = 1 96500 . 108 1 . 5 . 15 . 60 = 5 , 036 ( g )