

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án D:
![]()
Vì dung dịch sau điện phân hòa tan được Fe3O4 nên dung dịch sau điện phân có chứa H+.
Thứ tự các phản ứng xảy ra như sau:

Các bạn có thể viết các phương trình phản ứng như trên để dễ hiểu quá trình phản ứng và tính toán theo yêu cầu đề bài. Tuy nhiên, các bạn có thể rút ngắn quá trình tính toán mà không cần viết phương trình phản ứng như sau:
Ta có các bán phản ứng:



Đáp án A
nKCl = 0,1 mol, = 0,15 mol
2KCl + 2H2O 2KOH + H2 + Cl2
0,1 0,1 0,05 0,05 mol
mdung dịch giảm = 0,05.2 + 0,05 .71 = 3.65 g < 10,75 g
⟹ Cu(NO3)2 tiếp tục bị điện phân:
2Cu(NO3)2 + 2H2O 2Cu + 4 HNO3 + O2
x x 2x 0,5x
mdung dịch giảm = 10,75 - 3.65 = 7,1 = 64.x + 32.0,5x ⟹ x = 0,08875 (mol)
Nhận thấy:
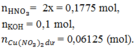

Chọn D.
Tại anot có khí Cl2 (0,5a mol) và O2 → BT : e n O 2 = 2 a - 0 , 5 a . 2 4 = 0 , 25 a mol ⇒ V = 16 , 8 a

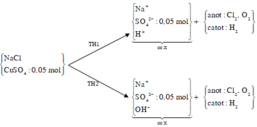
Đáp án B
+ Dung dịch X hòa tan được Al 2 O 3 , chứng tỏ X có chứa H + hoặc OH - .
+ Sơ đồ phản ứng


Chọn B.
Tại thời điểm t = 4632 giây ta có: ne = 0,36 mol
+ Khí thoát ra ở anot là Cl2 và O2 với

Tại thời điểm t = 6948 giây ta có: ne = 0,54 mol
+ Khí thoát ra ở anot là Cl2 (0,06 mol) và

và khí ở catot H2 với n H 2 = nkhí cả 2 điện cực – nkhí ở anot = 0,05 mol → BT : e b = 0,22 mol
(a) Sai, Tổng khối lượng hai muối trước điện phân là 44,14 gam.
(b) Đúng, Tại thời điểm t = 5790 giây ta có: ne = 0,45 mol mà 2 n Cu < n e nên tại thời gian này thì nước đã điện phân ở cả 2 điện cực.
(c) Sai, Giá trị của b là 0,22.
(d) Sai, Dung dịch X chứa 3 chất tan K2SO4, H2SO4 và CuSO4 dư.
(e) Sai, Đến thời điểm 6948 giây, số mol H+ sinh ra ở anot là 0,42 mol.