

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e
0,36 ←0,18 2x x 2x
2H2O + 2e → 2OH- + H2. 2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

Đáp án A
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+chưa điện phân hết
Tại t (s):
Catot: Cu2++2e→Cu
0,16←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu
Anot: 2Cl- → Cl2 + 2e
0,36←0,18
2H2O + 2e → 2OH- + H2.
2x x 2x
2H2O → 4H+ +O2 + 4e
2y → 4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

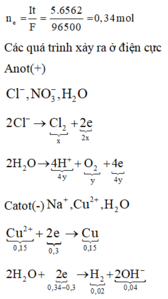
Vì dung dịch sau điện phân hòa tan được Fe tạo ra NO
Phải có điện phân nước ở bên anot
Bảo toàn e: 2x + 4y = 0,34


Đáp án C

Đáp án B
ne trao đổi = It/F = 5.6176/96500 = 0,32 mol
Cho Fe tác dụng với dung dịch sau đp thấy thoát ra khí NO Þ có H+ Þ Nước bị điện phân ở anot
Catot: Cu2+ + 2e → Cu
0,15 0,3 0,15
H2O + 1e → 0,5H2 + OH-
0,02 0,02 0,01 0,02
Anot: Cl- - 1e → 0,5Cl2
x x 0,5x
H2O + 2e → 0,5H2 + 2H+
0,32 – x 0,08 – 0,25x 0,32 – x
mdd giảm = mCu + mH2 + mCl2 + mO2 = 0,15.64 + 0,01.2 + 0,5x.71 + 32(0,08 – 0,25x) = 14.93 Þ x = 0,1
Dung dịch sau điện phân gồm: 0,2 ml H+; 0,3 mol NO3-; Na+. Khi cho Fe tác dụng với dung dịch sau đp:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Bđ 0,2 0,3
Pư 0,075 0,2 0,05
mFe = 0,075.56 = 4,2 gam

Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b => a + b = 0,12
Bảo toàn e: n e = 2a + 4b
Lúc 2t giây: n e = 4a + 8b
Lúc này ở anot thu được Cl2 a mol và O2
Do vậy ở catot thu được là H2 với số mol H2
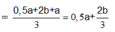
Bảo toàn e: n C u 2 +
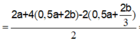
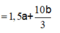
![]()
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.