Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án
Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,3% theo khối lượng. Để xác minh hàm lượng lưu huỳnh trong một loại nhiên liệu, người ta lấy nhiên liệu đem nghiền nhỉ gọi là hiện tượng vật lý, rồi đem đốt cháy hoàn toàn thu được hỗn hợp khí gồm cacbon dioxit, lưu huỳnh dioxit. Sau đó, dẫn khí vào dung dịch nước vôi trong thấy tạo kết tủa trắng gọi là hiện tượng hóa học

Thành phần theo khối lượng:
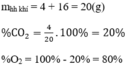
Thành phần phần trăm theo thể tích:


Khối lượng của các khí:
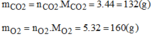
Thành phần phần trăm theo khối lượng:
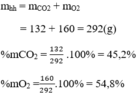
Thành phần phần trăm theo thể tích:
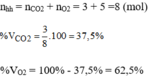

\(a,m_C=48\left(g\right)\rightarrow n_C=\dfrac{m_C}{M_C}=\dfrac{48}{12}=4\left(mol\right)\)
\(V_{O_2}=44,8\left(l\right)\rightarrow n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{44,8}{22,4}=2\left(mol\right)\)
\(PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(pt:\) \(1mol\) \(1mol\)
\(đb:\) \(4mol\) \(2mol\)
Xét tỉ lệ:
\(\dfrac{n_{C\left(đb\right)}}{n_{C\left(pt\right)}}=\dfrac{4}{1}=4>\dfrac{n_{O_2\left(đb\right)}}{n_{O_2\left(pt\right)}}=\dfrac{2}{1}=2\)
\(\Rightarrow\) \(O_2\) hết, \(C\) dư.
\(b,PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(pt:\) \(1mol\) \(1mol\)
\(đb:\) \(2mol\) \(2mol\)
\(\Rightarrow m_{CO_2}=n_{CO_2}.M_{CO_2}=2.\left(1.C+2.O\right)=2.\left(1.12+2.16\right)=88\left(g\right)\)
\(a.n_C=\dfrac{48}{12}=4\left(mol\right);n_{O_2}=\dfrac{44,8}{22,4}=2\left(mol\right)\\ C+O_2\xrightarrow[t^0]{}CO_2\)
Theo pt:\(\dfrac{4}{1}>\dfrac{2}{1}\Rightarrow C\) dư, O2 pư hết
\(b.C+O_2\xrightarrow[t^0]{}CO_2\\ \Rightarrow n_{CO_2}=n_{O_2}=2mol\\ m_{CO_2}=2.44=88\left(g\right)\)

C + O2 --> CO2
CO2 + Ca(OH)2 -- > CaCO3 + H2O
mkt = mCaCO3 = 10/100 = 0,1 (mol)
=> C = 0,1 (mol)
=> mC = 0,1.12 = 1,2 (g)
Vậy m mẫu than ban đầu là 1,2 gam

a) C + O2 --to--> CO2
b) \(n_C=\dfrac{6}{12}=0,5\left(mol\right)\)
PTHH: C + O2 --to--> CO2
0,5-->0,5------->0,5
=> mCO2 = 0,5.44 = 22 (g)
c) VO2 = 0,5.22,4 = 11,2 (l)
d) Vkk = 11,2.5 = 56 (l)

X gồm O2 dư và CO2
CO2+ Ca(OH)2 -> CaCO3+ H2O
nCaCO3= nCO2= 0,08 mol
nX= 0,1 mol
=> nO2 dư= 0,02 mol
C+ O2 ⟶ CO2
=> nC= nO2 phản ứng= nCO2= 0,08 mol
Tổng nO2= 0,08+0,02= 0,1 mol
=> V= 2,24l
mC= 0,08.12= 0,96g
Than chứa 96% C nên lượng than đem đốt là 0,96:96%= 1g
Pt thứ 2 có nhiệt độ nha bn:)

PTHH: C + O2 =(nhiệt)=> CO2
CO2 + Ca(OH)2 ===> CaCO3 + H2O
Ta có: nCaCO3 = \(\frac{2}{100}=0,02\left(mol\right)\)
Áp dụng định luật bảo toàn nguyên tố C, ta có:
nC(theo phương trình) = nCaCO3 = 0,02 (mol)
Vì hiệu xuất là 90%
=> nC(thực tế) = \(\frac{0,02\times100}{90}=0,022\left(mol\right)\)
=> mC = 0,022 x 12 = 0,264 gam
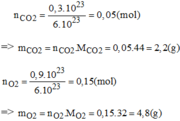
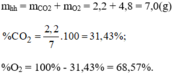
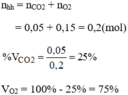
pt: C+O2--->CO2(1)
CO2+Ca(OH)2--->CaCO3+H2O(2)
nCaCO3=0,5/100=0,005(mol)
Theo pt (1) và (2) : nC=nCO2(1)=nCO2(2)=nCaCO3=0,005(mol)
=>mC=0,005.12=0,06(g)
=>%mC=0,06/10.100%=0,6%
ptpu: C + O2= CO2
CO2 + Ca(OH)2=CaCO3+H2O
nCaCO3= 0.5:100=0.005 mol
=> nCO2=nC=nCaCO3= 0.005 mol (theo ptpư)
=> mC=0.005*12=0.06(g)
%C= (mC/mthép)*100%= (0.06/10)*100=0.6%