Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) Để trung hòa HCl, số mol HCl phải bằng số mol NaOH. Vì vậy, ta có:
n(HCl) = n(NaOH)
x * 10 = 0,5 * 50
x = (0,5 * 50) / 10
x = 2,5 triệu
Vậy, nồng độ của dung dịch HCl là 2.5 M.
2) Ta có:
n(HCl) = n(NaOH)
n(HCl) = 0,1 * 20/10
Vậy, nồng độ của dung dịch HCl là 0.2 M.
\(1)n_{NaOH}=0,05.0,5=0,025mol\\ NaOH+HCl\rightarrow NaCl+H_2O\\ \Rightarrow n_{NaOH}=n_{HCl}=0,025mol\)
\(C_M\) \(_{HCl}=\dfrac{0,025}{0,01}=2,5M\)
\(2)n_{NaOH}=0,1.0,02=0,002mol\\ HCl+NaOH\rightarrow NaCl+H_2O\\ n_{NaOH}=n_{HCl}=0,002mol\)
\(C_M\) \(_{HCl}=\dfrac{0,002}{0,01}=0,2M\)

\(n_{NaOH}=0,02.0,1=0,002\left(mol\right)\\ HCl+NaOH\rightarrow NaCl+H_2O\\ \Rightarrow n_{HCl}=n_{NaOH}=0,002\left(mol\right)\\ \Rightarrow\left[HCl\right]=\dfrac{0,002}{0,01}=0,2M\)

a) \([OH^-]=\left[KOH\right]=1,5M\)
b) Để trung hòa dung dịch A: \(n_{\left[OH^-\right]}=n_{\left[H^+\right]}\)
\(\Rightarrow0,15=0,5\cdot V_{HCl}\Rightarrow V_{HCl}=0,3l=300ml\)

\(n_{HCl}=\dfrac{400.18,25\%}{36,5}=2\left(mol\right)\\ n_{Ba\left(OH\right)_2}=0,25.2=0,5\left(mol\right)\\ Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\\ 0,5...............1...............0,5\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ 1............1..............1\left(mol\right)\\ C\%_{ddNaOH}=\dfrac{1.40}{120}.100\approx33,333\%\)
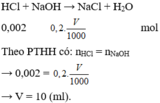
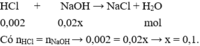
\(n_{NaOH}=0.025\left(mol\right)\)
\(\Rightarrow n_{OH^-}=0.025\left(mol\right)\)
\(H^++OH^-\xrightarrow[]{}H_2O\)
0.025 ← 0.025
\(\Rightarrow n_{HCl}=0.025\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0.025}{0.01}=2.5\left(M\right)\)