Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
m H F = 400 . 40 100 = 160 (gam) → n H F = 160 20 = 8 (mol)
Bảo toàn F có: n H F = 2. n C a F 2 → n C a F 2 = 4 mol.
m C a F 2 = 4 , 78 80 % = 390 (gam)

Chọn đáp án C
m H F = 200 . 40 100 = 80 (gam) => n H F = 80 20 = 4 (mol)
m C a F 2 = 4 . 1 2 . 78 . 100 80 = 195 (gam)

Đáp án D
![]() .100 = 40% => mHF =160 (g) => n HF = 8 (mol)
.100 = 40% => mHF =160 (g) => n HF = 8 (mol)
CaF2 + H2SO4 → CaSO4 + 2HF
4 ← 8 (mol)
Do H% = 60%=> ![]() = 5 mol
= 5 mol
m = 5. (40+19.2) = 390 (g)

mHF =\(\frac{40.2,5}{100}\) = 1kg
Phương trình phản ứng hóa học:
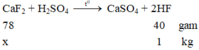
CaF2 + H2SO4 ---> CaSO4 + 2HF
78kg 40kg
X kg 1 kg
mCaF2 cần dùng: \(\frac{1.78}{40}.\frac{100}{80}\) = 2,4375 kg
mHF = = 1kg
Phương trình phản ứng hóa học:
CaF2 + H2SO4 CaSO4 + 2HF
78kg 40kg
X kg 1 kg
cần dùng:
= 2,4375 kg
khối lượng dung dịch H2SO4 98% và khối lượng H2O cần dùng để pha chế 300 gam dung dịch H2 SO4 36% là

Khối lượng H2SO4 trong 300g dd H2SO4 36% là :
\(m_{H_2SO_4}=300.36\%=108\left(g\right)\)
Khối lượng dung dịch H2SO4 98% cần dùng để pha chế 300g dd H2SO4 36% :
\(m_{ddH_2SO_4}=\frac{108}{98\%}=110,2\left(g\right)\)
=> Khối lượng H2O cần dùng : 300-110,2=189,8 (g)

Câu 2:
Gọi khối lượng của ddNaCl 2% và 10% lần lượt là m1 và m2
\(m_{NaCl\left(1\right)}=\dfrac{2}{100}m_1;m_{NaCl\left(2\right)}=\dfrac{10}{100}m_2\)
\(\Rightarrow m_{NaCl\left(3\right)}=\dfrac{2}{100}m_1+\dfrac{10}{100}m_2=0,02m_1+0,1m_2\) (1)
\(m_{ddNaCl\left(3\right)}=m_1+m_2\)
Ta có: \(m_{NaCl\left(3\right)}=\dfrac{8.\left(m_1+m_2\right)}{100}=0,08\left(m_1+m_2\right)\) (2)
Từ (1)(2)
\(\Rightarrow0,02m_1+0,1m_2=0,08m_1+0,08m_2\)
\(\Leftrightarrow0,02m_2=0,06m_1\Rightarrow\dfrac{m_1}{m_2}=\dfrac{0,02}{0,06}=\dfrac{1}{3}\)
Câu 1:
\(n_{KOH}=2,4.160=384\left(mol\right)\)
\(V_{ddKOH2M}=\dfrac{384}{2}=192\left(l\right)\)
⇒ Vnước thêm vào = 192-160 = 32 (l)
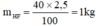
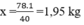
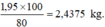

Ta có: \(m_{CuSO_4}=80\cdot10\%=8\left(g\right)\) \(\Rightarrow m_{H_2O}=80-8=72\left(g\right)\)