Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nN2O = \(\dfrac{0,616}{22,4}\)= 0,0275 mol
2N+5 + 8e --> N2+1
0,22<------- 0,0275
nNO3- tạo muối = ne trao đổi = 0,22 mol
=> mNO3- tạo muối = 0,22.62 = 13,64 gam
mMuối = mKL + mNO3- = 3,37 + 13,64 = 17,01 gam

Coi : B gồm : Fe ( x mol) , O ( y mol)
\(m_B=56x+16y=12\left(h\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
Bảo toàn e :
\(3x=2y+0.15\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\left(g\right)\)
Quy đổi hỗn hợp về Fe và O.
Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_O=y\left(mol\right)\end{matrix}\right.\)
⇒ 56x + 16y = 12 (1)
Ta có: \(n_{SO_2}=0,15\left(mol\right)\)
Theo ĐLBT mol e, có: 3x - 2y = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,18\left(mol\right)\\y=0,12\left(mol\right)\end{matrix}\right.\)
⇒ mFe = 0,18.56 = 10,08 (g)
Bạn tham khảo nhé!

\(m_{SO_4}=m_{muối.sunfat}-m_{kim.loai}=79,44-19,92=59,52\left(g\right)\)
=> \(n_{SO_4}=\dfrac{59,52}{96}=0,62\left(mol\right)\)
=> \(n_{H_2SO_4\left(pư\right)}=0,62\left(mol\right)\)
\(n_{O_2\left(pư\right)}=\dfrac{25,04-19,92}{32}=0,16\left(mol\right)\)
Bảo toàn O: \(n_{H_2O}=0,32\left(mol\right)\)
Bảo toàn H: \(n_{H_2}=\dfrac{0,62.2-0,32.2}{2}=0,3\left(mol\right)\)
=> V = 0,3.22,4 = 6,72 (l)

- Từ quá trình phản ứng ta thấy số oxi hoá của các chất phản ứng ở trạng thái đầu là
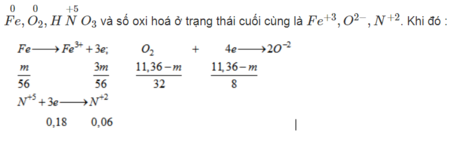
Áp dụng ĐLBT electron ta có:
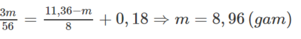
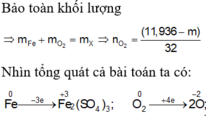
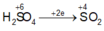
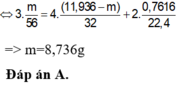




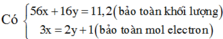
Ta có sơ đồ phản ứng :
Fe + O2 → Oxit , (Fe dư ) Fe(NO3) + NO + H2O
Fe(NO3) + NO + H2O
Gọi số mol Fe ban đầu là x mol , số mol oxi phản ứng là y mol
Fe → Fe+3 + 3e O2 +4e → 2O-2
N+5 + 3e → N+2
Áp dụng ĐLBT eletron ta có : 3x = 4y + 0,05.3 (1)
Áp dụng ĐLBT khối lượng : 56x + 32y = 6 (2)
Giải hệ pt gồm (1),(2) => x = 0,09 , y = 0,03
=> mFe = 0,09.56 = 5,04 gam