Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt x,y, z lần lượt là số mol của Na,Al,Mg trong m gam hỗn hợp A
m gam A + H2O dư
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
x--------------------x--------->0,5x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x<------x-------------------------------------->1,5x
=> \(0,5x+1,5x=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) (1)
2m gam A + NaOH
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
2x------------------------------->x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2y---------------------------------------------->3y
=> \(x+3y=\dfrac{8,96}{22,4}=0,4\left(mol\right)\) (2)
3m gam A + HCl
\(Na+HCl\rightarrow NaCl+\dfrac{1}{2}H_2\)
3x--------------------------->1,5x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
3y----------------------------->4,5y
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
3z----------------------------->3z
=> \(1,5x+4,5y+3z=\dfrac{22,4}{22,4}=1\left(mol\right)\) (3)
Từ (1), (2), (3) =>\(\left\{{}\begin{matrix}x=0,05\\y=\dfrac{7}{60}\\z=\dfrac{2}{15}\end{matrix}\right.\)
=> \(m_{Na}=0,05.23=1,15\left(g\right)\)
\(m_{Al}=\dfrac{7}{60}.27=3,15\left(g\right)\)
\(m_{Mg}=\dfrac{2}{15}.24=3,2\left(g\right)\)
=> \(m=1,15+3,15+3,2=7,5\left(g\right)\)
=> \(\%m_{Na}=\dfrac{1,15}{7,5}.100=15,33\%\)
\(\%m_{Al}=\dfrac{3,15}{7,5}.100=42\%\)
\(\%m_{Mg}=\dfrac{3,2}{7,5}.100=42,67\%\)

\(2Na+2H2O\rightarrow2NaOH+H2\left(1\right)\)
\(2Al+2NaOH+2H2O\rightarrow2NaAlO2+3H2\left(2\right)\)
\(2Al+6HCl\rightarrow2AlCl3+3H2\left(3\right)\)
\(2Na+2HCl\rightarrow2NaCl+H2\left(4\right)\)
\(Mg+2HCl\rightarrow MgCl2+H2\left(5\right)\)
\(n_{H2\left(1\right)}=0,1\left(mol\right)\rightarrow n_{Na}=0,2\left(mol\right)\rightarrow m_{Na}=4,6\left(g\right)\)
\(n_{H2\left(2\right)}=0,4\left(mol\right)\Rightarrow n_{Al}=\dfrac{4}{15}\left(mol\right)\Rightarrow m_{Al}=7,2\left(g\right)\)
\(\Rightarrow n_{H2\left(3\right)}=\dfrac{3}{2}n_{Al}=0,4\left(mol\right)\)
\(n_{H2\left(4\right)}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\)
\(\Rightarrow n_{H2\left(5\right)}=1-0,4-0,1=0,5\left(mol\right)\)
\(\Rightarrow n_{Mg}=0,5\left(mol\right)\Rightarrow m_{Mg}=12\left(g\right)\)
\(\Rightarrow m=12+4,6+7,2=23,8\left(g\right)\)
\(\%m_{Na}=\dfrac{4,6}{23,8}.100\%=19,33\%\)
\(\%m_{Al}=\dfrac{7,2}{23,8}.100\%=30,25\%\)
\(\%m_{Mg}=100-19,33-30,25=50,42\%\)
Chúc bạn học tốt

a)X gồm Fe,Ag
\(Fe + 2AgNO_3 \to Fe(NO_3)_2 + Ag(1)\\ Fe + 2HCl \to FeCl_2 + H_2(2)\\ 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(3)\\ 2Ag + 2H_2SO_4 \to Ag_2SO_4 + SO_2 + 2H_2O(4)\\\)
b) Phần 1,gọi n\(n_{Ag} = a(mol)\)
Theo PTHH (2) : \(n_{Fe} = n_{H_2} = 0,1(mol)\)
Suy ra : m2 = 0,1.56 + 108a = 5,6 + 108a(gam)
Phần 2, \(n_{Ag} = ak(mol) ; n_{Fe} = 0,1k(mol)\)
Theo PTHH (3)(4) : \(n_{SO_2} = \)0,5.ak + 0,1k.1,5 = 0,5ak + 0,15k = 0,4
⇒ k(0,5a + 0,15) = 0,4(1)
m3 = 108.ak + 0,1k.56 (gam)
Ta có :
\(m_3 - m_2 = 16,4 \Rightarrow m_3 = 16,4 + m_2\)
⇔ k(108a + 5,6) = 16,4 + 5,6 + 108a = 22+ 108a(2)
Ta lấy (1) : (2), ta có :
\(\dfrac{0,5a + 0,15}{108a + 5,6} = \dfrac{0,4}{22 + 108a}\)⇒ a = 0,1
Vậy : k = \(\dfrac{0,4}{0,5a + 0,15} = 2\)
Vậy X gồm :
Fe : 0,1 + 0,1.2 = 0,3(mol)
Ag : 0,1 + 0,1.2 = 0,3(mol)
Fe + 2AgNO3 →Fe(NO3)2 + 2Ag
0,3.....0,3...............................0,3.........(mol)
Vậy :
m = (0,3 + 0,3).56 = 33,6 gam
V = \(\dfrac{0,3}{1}\) = 0,3(lít)
phần tính a bạn giải chi tiết dùm mình dc không, mình giải ko ra

1.
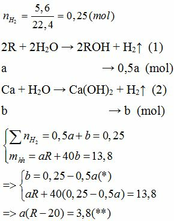
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
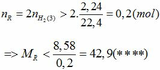
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
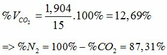
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
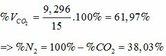

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a)
Gọi $n_{Al} = a(mol); n_{Fe} = b(mol)$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 1,5a = \dfrac{9,6}{32} = 0,3 \Rightarrow a = 0,2(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = 1,5a + b = 0,4 \Rightarrow b = 0,1(mol)$
$\Rightarrow m = 0,2.27 + 0,1.56 = 11(gam)$
b)
$AlCl_3 + 3NaOH \to Al(OH)_3 + 3NaCl$
$Al(OH)_3 + NaOH \to NaAlO_2 + 2H_2O$
$FeCl_2 + 2NaOH \to Fe(OH)_2 + 2NaCl$
$n_{Fe(OH)_2} = n_{Fe} = 0,1(mol)$
$m_{Fe(OH)_2} = 0,1.90 = 9(gam)$

\(n_{KOH}=0,1.2=0,2mol\\ n_{MgSO_4}=0,1.0,8=0,08mol\\ n_{H_2SO_4}=0,1.0,4=0,04mol\)
Vì bazo và axit luôn pư trc nên H2SO4 hết MgSO4 dư.
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,08 0,04 0,04 0,08
\(2KOH+MgSO_4\rightarrow Mg\left(OH\right)_2+K_2SO_4\)
0,12 0,06 0,06 0,06
\(Mg\left(OH\right)_2\underrightarrow{t^0}MgO+H_2O\)
0,06 0,06 0,06
\(m_1=m_{Mg\left(OH\right)_2}=0,06.58=3,48g\\ m_2=m_{MgO}=0,06.40=2,4g\\ C_{M\left(K_2SO_4\right)}=\dfrac{0,04+0,06}{0,1+0,1}=0,5M\\ C_{M\left(MgSO_4\right)}=\dfrac{0,08-0,06}{0,1+0,1}=0,1M\)
Bài 1:
nH2 = \(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt: FeO + H2 --to--> Fe + H2O (1)
......ZnO + H2 --to--> Zn + H2O (2)
Theo pt (1), (2): nkim loại = nH2 = 0,1 mol
Pt: Fe + 2HCl --> FeCl2 + H2 (3)
......Zn + 2HCl --> ZnCl2 + H2 (4)
Theo pt (3), (4): nH2 = nkim loại = 0,1 mol
VH2 = 0,2 . 22,4 = 2,24 (lít)
Bài 2:
Pt: 2Na + 2H2O --> 2NaOH + H2
......\(\dfrac{m_1}{23}\)-------------> \(\dfrac{m_1}{23}\)----> \(\dfrac{m_1}{46}\)
mNaOH = \(\dfrac{40m_1}{23}\)
mdd sau pứ = m1 + p - \(\dfrac{m_1}{23}\)
Ta có: \(a=\dfrac{\dfrac{40m_1}{23}}{m_1+p-\dfrac{m_1}{23}}\) (1)
Pt: Na2O + H2O --> 2NaOH
......\(\dfrac{m_2}{62}\)-------------> \(\dfrac{m_2}{31}\)
mNaOH = \(\dfrac{40m_2}{31}\)
mdd sau pứ = m2 + p
\(a=\dfrac{\dfrac{40m_2}{31}}{m_2+p}\) (2)
Từ (1) và (2): \(\dfrac{\dfrac{40m_1}{23}}{m_1+p-\dfrac{m_1}{23}}\) = \(\dfrac{40m_2}{m_2+p}\)
P/s: tới đây bạn rút gọn tiếp nha