Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol của sắt (III) oxit
nFe2O3 = \(\dfrac{m_{Fe2O3}}{M_{Fe2O3}}=\dfrac{32}{160}=0,2\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{30.218}{100}=65,4\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{65,4}{36,5}=1,8\left(mol\right)\)
Pt : Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(|\)
1 6 2 3
0,2 1,8 0,4
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{1,8}{6}\)
⇒ Fe2O3 phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe2O3
Số mol của sắt (III) clorua
nFeCl3 = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của sắt (III) clorua
mFeCl3 = nFeCl3 . MFeCl3
= 0,4. 162,5
= 65 (g)
Số mol dư của dung dịch axit clohidric
ndư= nban đầu -nmol
= 1,8 - \(\left(\dfrac{0,2.6}{1}\right)\)
= 0,6 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư . MHCl
= 0,6 . 36,5
= 21,9 (g)
Khối lượng của dung dịch sau hản ứng
mdung dịch sau phản ứng = mFe2O3 + mHCl
= 32 + 218
= 250 (g)
Nồng độ phần trăm của sắt (III) clorua
C0/0FeCl3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{65.100}{250}=26\)0/0
Nồng độ phần trăm của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{21,9.100}{250}=8,76\)0/0
Chúc bạn học tốt

Bài 2
Gọi x, y là số mol củaCuO và ZnOmol HCl=3.0,1=0,3mol(100ml=0,1l)
CuO+2HCl->CuCl2+H2O (1)
xmol 2xmol
ZnO+2HCl->ZnCl2+H2O(2)
ymol 2ymol
Từ 1 và 2 ta co hệ phương trình
2x+2y=0,3 ->x=0,05=molCuO
80x+81y=12,1 ->y=0,1=molZnO
=>mCuO=0,05.80=4g
->%CuO=(4.100)/12,1=33,075%
->%ZnO=100-33,075=66,943%
b. CuO+H2SO4->CuSO4+H2O (3)
Theo ptpu 3 taco nH2SO4=nCuO=0,05 mol
ZnO+H2SO4->ZnSO4+H2O (4)
Theo ptpu 4 ta co nH2SO4=nZnO=0,1mol
=>nH2SO4=0.05+0,1=0,15mol
->mH2SO4=0,15.98=14,7g
=>mddH2SO4=(14,7.100)/20=73,5g
Bài 1
a/. Phương trình phản ứng hoá học:
Fe + 2HCl --> FeCl2 + H2
b/. nH2 = V/22,4 = 3,36/22,4 = 0,15 (mol)
....... Fe.....+ 2HCl --> Fecl2 + H2
TPT 1 mol....2 mol.................1 mol
TDB x mol....y mol................0,15 mol
nFe = x = (0,15x1)/1 = 0,15 (mol)
mFe = n x M = 0,15 x 56 = 8,4 (g)
c/. nHCl = y = (0,15x2)/1 = 0,3 (mol)
CMHCl = n/V = 0,3/0,05 = 6 (M)

\(n_{Fe2O3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(m_{ct}=\dfrac{7,3.400}{100}=29,2\left(g\right)\)
\(n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
Pt : \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O|\)
1 6 2 3
0,1 0,8 0,2
Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,8}{6}\)
⇒ Fe2O3 phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe2O3
\(n_{FeCl3}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl3}=0,2.162,5=32,5\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,8-\left(0,1.6\right)=0,2\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)
\(m_{ddspu}=16+400=416\left(g\right)\)
\(C_{FeCl3}=\dfrac{32,5.100}{416}=7,8125\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{7,3.100}{416}=1,75\)0/0
Chúc bạn học tốt


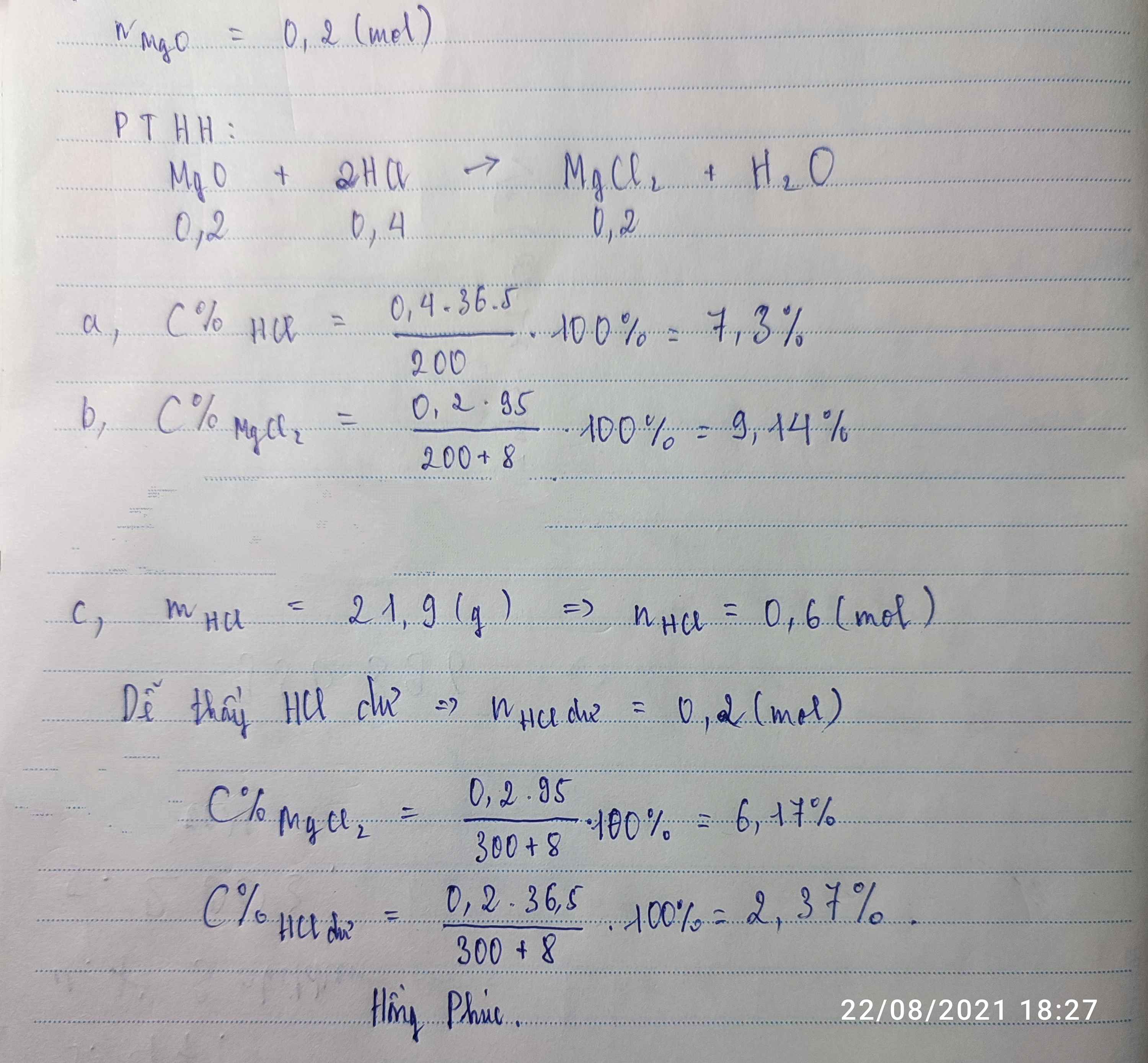

a)Theo bài ta có;
\(n_{Fe_2O_3}=\dfrac{m_{Fe_2O_3}}{M_{Fe_2O_3}}=\dfrac{3,2}{160}=0,02\left(mol\right)\)
pthh:\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
số mol__0,2_____1,2
Theo bài và pthh ta có:
\(n_{HCl}=6\cdot n_{Fe_2o_3}=6\cdot0,2=1,2\left(mol\right)\)
\(\Rightarrow m_{HCl}=n_{HCl}\cdot M_{HCl}=1,2\cdot36,5=43,8\left(g\right)\)
\(\Rightarrow C\%=\dfrac{m_{HCl}}{m_{ddHCl}}=\dfrac{43,8}{200}=21,9\%\)
b)
\(m_{HCl}=\dfrac{C\%\cdot m_{ddHCl2,5\%}}{100\%}=\dfrac{2,5\%\cdot200}{100\%}=5\left(g\right)\)
\(\Rightarrow n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{5}{36,5}\approx0,137\left(mol\right)\)
Ta có :
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
số mol bđ: 0,2______0,137
số mol tgpư: 0,022_____0,137
số mol dư: 0,178______0
⇒ Sau phản ứng Fe2O3 còn dư,HCl tgpuw hết.
⇒DD sau pư gồm FeCl3 và Fe2O3 dư
Ta có
\(n_{FeCl_3}=\dfrac{1}{3}\cdot n_{HCl}=\dfrac{1}{3}\cdot0,137\approx0.045\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=n_{FeCl_3}\cdot M_{FeCl_3}=0,045\cdot162,5=7,3125\left(g\right)\)
\(m_{Fe_2O_3dư}=n_{Fe_2O_3dư}\cdot M_{Fe_2O_3}=0,178\cdot160=28,48\left(g\right)\)
\(m_{ddspuw}=m_{Fe_2O_3}+m_{ddHCl}=3,2+200=203,2\left(g\right)\)
\(\Rightarrow C\%_{FeCl_3}=\dfrac{m_{FeCl3}\cdot100\%}{m_{ddspuw}}=\dfrac{7,3125\cdot100\%}{203,2}\approx3,6\%\)
\(\Rightarrow C\%_{Fe2O3dư}=\dfrac{m_{Fe2O3duw}\cdot100\%}{m_{ddspuw}}=\dfrac{28,48\cdot100\%}{203,3}=14,01\%\)
Chúc bạn học tốt