Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Cấu hình electron của N (Z = 7): 1s22s22p3
- Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho 2 nguyên tử N.
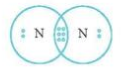
⟹ Số cặp electron dùng chung là 3.
⟹ Công thức Lewis của N2:
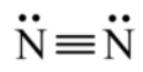

- Phân tử H2O:
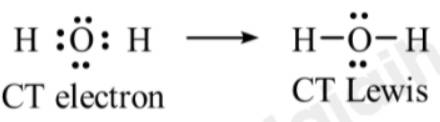
⟹ Phân tử H2O có 2 cặp electron hóa trị riêng.
- Phân tử CH4:
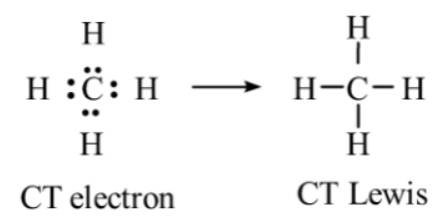
⟹ Phân tử CH4 không có cặp electron hóa trị riêng.

- Từ công thức electron của CO2:
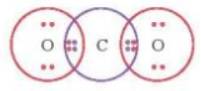
⟹ Mỗi nguyên tử O có 2 cặp electron dùng chung với nguyên tử C.
- Viết công thức Lewis của CO2: O = C = O

Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1)
N (Z = 7): 1s22s22p3
H (Z = 1): 1s1
Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3
H có 1e ở lớp electron ngoài cùng, N có 5e ở lớp electron ngoài cùng.
⟹ Mỗi nguyên tử góp chung 1e để đạt cấu hình khí hiếm bền vững.
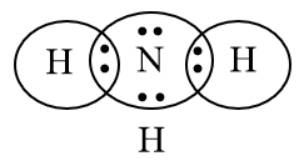
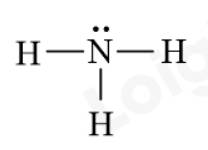
Bước 3: Công thức Lewis của NH3

- Nguyên tố H và F sẽ góp chung 1 electron để đạt cấu hình electron bền vững.
⟹ Số electron chung là: 2
- H có hóa trị cao nhất là I ⟹ Electron hóa trị riêng của H là 1.
- F có hóa trị cao nhất là IIV ⟹ Electron hóa trị riêng của F là 7.

Các nguyên tố thuộc nhóm VIIA gồm các nguyên tố : flo (F), clo (Cl), brom (Br), iot (I), atatin (At). Nguyên tử của chúng có 7 electron hoá trị.
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử góp 1 electron, tạo thành một cặp electron chung tức là một liên kết, vì mỗi nguyên tử chỉ thiếu electron để đạt được cấu hình 8 electron vững bền (giống như của khí hiếm đứng sau nó).
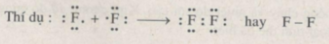

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.
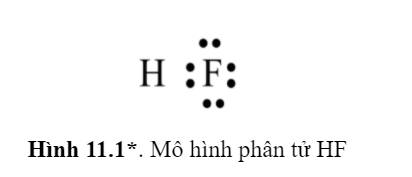

- Trong phân tử phosphorus trichloride gồm 2 nguyên tố: P và Cl
+ Nguyên tử P có 5 electron ở lớp ngoài cùng => Góp chung 3 electron độc thân để hình thành 3 liên kết cộng hóa trị
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng => 3 nguyên tử Cl, mỗi nguyên tử góp chung 1 electron độc thân để hình thành 3 liên kết cộng hóa trị với P.
=> Khi đó, quanh P và Cl đều có 8 electron như khí hiếm Argon.
- Công thức Lewis của phân tử: