Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nxenlulozo trinitrat = \(\dfrac{23,76}{297n}=\dfrac{0,08}{n}\left(mol\right)\)
[C6H7O2(OH)3]n + 3nHNO3 --> [C6H7O2(ONO2)3]n + 3nH2O
=> \(n_{HNO_3\left(PTHH\right)}=\dfrac{0,08}{n}.3n=0,24\left(mol\right)\)
=> nHNO3(thực tế) = \(\dfrac{0,24.100}{60}=0,4\left(mol\right)\)
=> mHNO3(thực tế) = 0,4.63 = 25,2 (g)
=> \(m_{ddHNO_3}=\dfrac{25,2.100}{65}=\dfrac{504}{13}\left(g\right)\)
=> \(V_{ddHNO_3}=\dfrac{\dfrac{504}{13}}{1,5}=25,85\left(l\right)\)
=> D

Đáp án C
Bỏ qua hệ số n trong tính toán cho đơn giản.
[C6H7O2(OH)3]n + 3nHNO3 → [C6H7O2(ONO2)3]n + 3nH2O
3.63 297
34,02 ← 53,46 kg
Vì H = 60% → m(HNO3 lý thuyết) = 34,02 : 0,6 = 56,7 kg.
→ m(dd HNO3) = 56,7 : 94,5% = 60 kg → V = m : D = 40 lít.

Chọn đáp án D
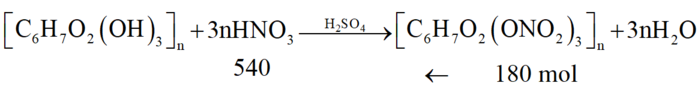
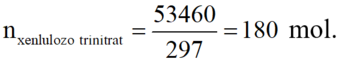
Vì hiệu suất là 60% nên số mol HNO3 cần dùng là:
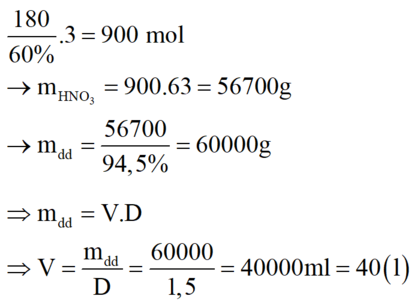

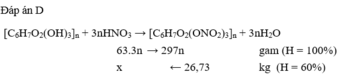

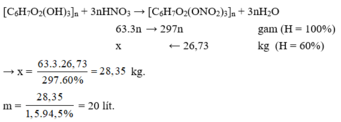

Chọn D.
29.