Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

I. Bài tập trắc nghiệm :
Câu 1. Thành phần chính của khí đồng hành là:
A. C2H2. B. CH4. C. C2H4. D. H2.
Câu 2. Để dập tắt đám cháy nhỏ do xăng, dầu người ta dùng biện pháp
A. phun nước vào ngọn lửa. B. phủ cát vào ngọn lửa.
C. thổi oxi vào ngọn lửa. D. phun dung dịch muối ăn vào ngọn lửa.
Câu 3. Dầu mỏ nước ta có hàm lượng hợp chất chứa lưu huỳnh là:
A. nhỏ hơn 0,5%. B. lớn hơn 0,5%. C. bằng 0,5%. D. bằng 0,05%.
Câu 4. Chọn câu đúng trong các câu sau:
A. dầu mỏ là một đơn chất. B. dầu mỏ là một hợp chất phức tạp
C. dầu mỏ là một hỗn hợp tự nhiên của nhiều hiđrocacbon. D. dầu mỏ sôi ở một nhiệt độ xác định.
Câu 5. Crăckinh dầu mỏ để thu được:
A. hỗn hợp gồm nhiều hiđrocacbon có phân tử khối nhỏ hơn. B. dầu thô.
C. hỗn hợp gồm nhiều hiđrocacbon có phân tử khối lớn hơn. D. hiđrocacbon nguyên chất.
Câu 6. Trong các loại than dưới đây, loại than già nhất có hàm lượng cacbon trên 90% là:
A. than gầy. B. than mỡ. C. than non. D. than bùn.
Câu 7. Người ta đang nghiên cứu để sử dụng nguồn nhiên liệu khi cháy không gây ô nhiễm môi trường là
A. CH4. B. H2. C. C4H10. D. CO.
Câu 8. Trong các loại than dưới đây, loại than trẻ nhất có hàm lượng cacbon thấp nhất là
A. than gầy. B. than mỡ. C. than non. D. than bùn.
Câu 9. Để sử dụng nhiên liệu có hiệu quả cần phải cung cấp không khí hoặc oxi:
A. vừa đủ. B. thiếu . C. dư. D. vừa đủ hoặc dư.
Câu 10. Thể tích oxi cần dùng để đốt cháy hoàn toàn 10 lít khí thiên nhiên chứa 96% metan CH4; 2% nitơ N2 và 2% khí cacbon đioxit là (các thể tích khí đo trong cùng điều kiện nhiệt độ, áp suất).
A. 9,6 lít. B. 19,2 lít. C. 28,8 lít. D. 4,8 lít.

0,5atm và 0oC hình như là 44,8 lít đó.
Tính số mol H2 = 0,05 (mol )
Gọi M là KLTB của hai kim loại
\(M_A< \overline{M}< M_B\)
\(\overline{M}+H_2O\rightarrow\overline{M}OH+\dfrac{1}{2}H_2\uparrow\)
0,1 <-----------------------0,05
\(M_{\overline{M}}=\dfrac{3,6}{0,1}=36\)
=> \(M_A< 36< M_K\) (1)
Vậy khối lượng ngtử A < Kali
b) Theo gt: \(n_A>0,1.10\%=0,01\)
=> \(n_K< 0,09\)
=> \(m_K< 0,09.39=3,51\)
\(M_A>\dfrac{3,6-3,51}{0,01}=9\) (2)
(1)(2) \(\Rightarrow\) A là Natri
c) \(\left\{{}\begin{matrix}39x+23y=3,6\\0,5x+0,5y=0,05\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,08125\\y=0,01875\end{matrix}\right.\)
\(m_K=39.0,08125=3,16875\left(g\right)\)
\(m_{Na}=0,01875.23=0,43125\left(g\right)\)
sản phẩm tự thế số vô tính đi nha
Bài này mol hơi xấu nhỉ, nếu lấy TH kim loại A là Li thì mol sẽ đẹp

Không vì cần phải tốn thêm chi phí để có thể lọc lưu huỳnh. Người ta chỉ sử dụng dâu mỏ ít tạp chất và giàu các hidrocacbon .

\(2SO_2+O_2\xrightarrow[450^0C]{V_2O_5}2SO_3\)
\(SO_3+H_2O-->H_2SO_4\)
Khí SO2 ở trong không khí và hơi nước bị oxi hóa chậm tạo thành H2SO4.
SO2 + O2 + H2O \(\rightarrow\) H2SO4

(a) Phương trình hóa học: Na2SO4 + Pb(NO3)2 → PbSO4 ↓ + 2NaNO3
Phương trình ion thu gọn: Pb2+ + SO42- → PbSO4 ↓
(b) Do dung dịch qua lọc thấy có tạo kết tủa với dung dịch Pb(NO3)2 0,5 M, trái lại không cho kết tủa với dung dịch Na2SO4 0,5 M nên Pb(NO3)2 phản ứng hết, Na2SO4 còn dư
Số mol của kết tủa:
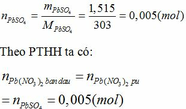
Khối lượng của Pb(NO3)2 trong hỗn hợp ban đầu là:
Thành phần phần trăm về khối lượng của Pb(NO3)2 trong hỗn hợp ban đầu là:


Đáp án A