Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
pthh: \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
0,1 0,1 0,1
=>\(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\m_{H_2O}=0,1.18=1,8\left(g\right)\end{matrix}\right.\)

\(n_{Zn}=\dfrac{19.5}{65}=0.3\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{98}{98}=1\left(mol\right)\)
\(n_{CuO}=\dfrac{36}{80}=0.45\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.3.....................................0.3\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.......0.3.....0.3....0.3\)
\(m_{Cr}=m_{CuO\left(dư\right)}+m_{Cu}=\left(0.45-0.3\right)\cdot80+0.3\cdot64=31.2\left(g\right)\)
\(m_{H_2O}=0.3\cdot18=5.4\left(g\right)\)
Chúc em học tốt !!
Zn+H2SO4→ZnSO4+H2 bạn biến đổi nó ra phương trình này kiểu gì vậy?

CuO+H2-to>Cu+H2O
0,09----0,09---0,09
n CuO=\(\dfrac{7,2}{80}\)=0,09 mol
=>m Cu=0,09.64=5,76g
=>VH2=0,09.22,4=2,016l
\(n_{CuO}=\dfrac{7,2}{80}=0,09mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,09 0,09 0,09 ( mol )
\(m_{Cu}=0,09.64=5,76g\)
\(V_{H_2}=0,09.22,4=2,016l\)

A. \(H_2+CuO\rightarrow Cu+H_2O\)
B. \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Cu}=n_{CuO}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,1.64=6,4\left(g\right)\)
C. Theo PTHH: \(n_{H_2}=n_{CuO}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)

a) mCuO = 40g
b) Pt: H2 + CuO --> Cu + H2O
...................x mol.....x mol
nCuO ban đầu = \(\frac{40}{80}=0,5\) mol
Nếu CuO pứ hết -> nCu = 0,5 mol
=> mCu = 0,5 . 64 = 32g < 35,3g
Vậy CuO không pứ hết
Gọi x là số mol CuO tham gia pứ
64x + (0,5 - x).80 = 35,3
=> x = 0,3 mol
Hiệu suất pứ:
H = \(\frac{0,3}{0,5}\) . 100% = 60%
c) nH2O = nCuO tham gia pứ = 0,3 mol
=> Số phân tử H2O = \(6\times 0,3\times 10^{23}=1,8\times 10^{23}\)

\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(n_{CuO}=\dfrac{40}{80}=0.5\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(1...........1\)
\(0.5............0.1\)
\(LTL:\dfrac{0.5}{1}>\dfrac{0.1}{1}\Rightarrow CuOdư\)
\(m_{cr}=m_{CuO\left(dư\right)}+m_{Cu}=\left(0.5-0.1\right)\cdot80+0.1\cdot64=39.4\left(g\right)\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{CuO}=\dfrac{40}{80}=0,5\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,5}{1}>\dfrac{0,1}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{CuO\left(pư\right)}=n_{H_2}=0,1\left(mol\right)\)
⇒ nCuO dư = 0,4 (mol)
⇒ m chất rắn = mCu + mCuO dư = 0,1.64 + 0,4.80 = 38,4 (g)
Bạn tham khảo nhé!
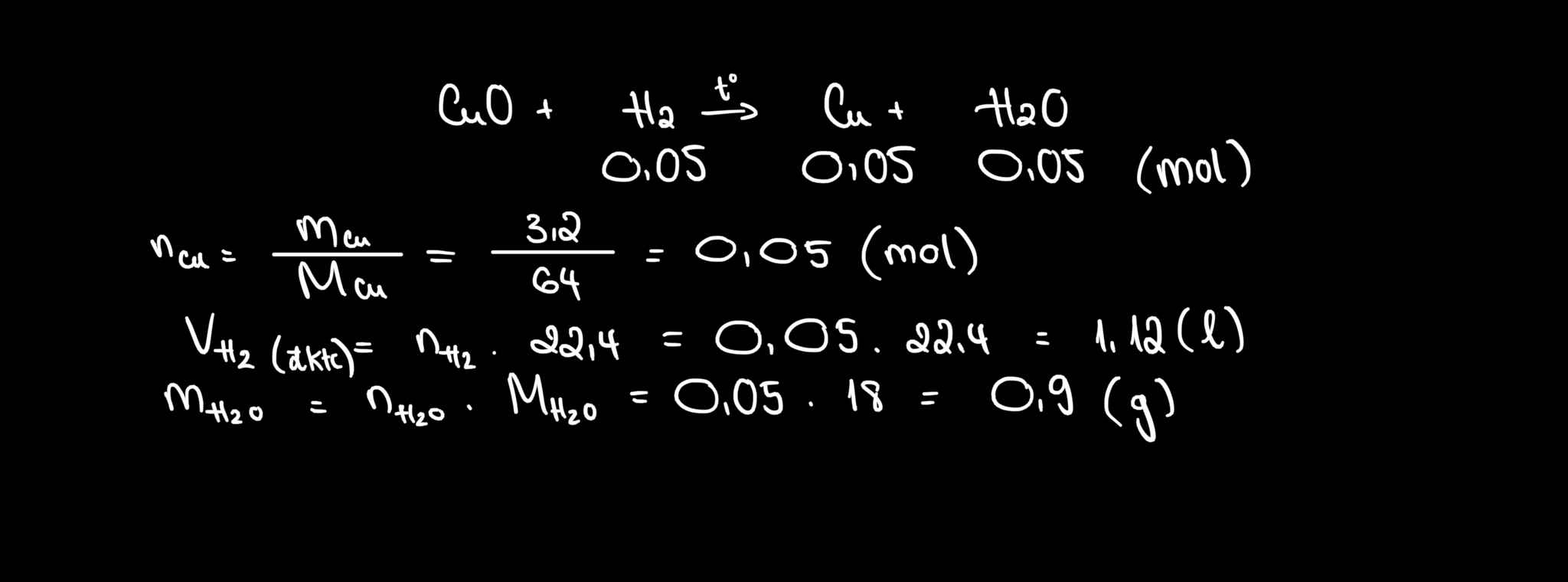
a) \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
__________0,1<--------0,1
=> VH2 = 0,1.22,4 = 2,24(l)
b) \(n_{CuO}=\dfrac{40}{80}=0,5\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
______0,5-------------->0,5
=> mCu = 0,5.64 = 32(g)
CuO + H2 \(\underrightarrow{t^o}\) Cu + H2O
a,
\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\\ \Rightarrow n_{H_2}=0,1mol\\ V_{H_2}=0,1.22,4=2,24l\)
b, \(n_{CuO}=\dfrac{40}{80}=0,5mol\\ \Rightarrow m_{Cu}=0,5.64=32g\)