Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2NH3+ 3CuO N2+ 3Cu + 3H2O
nNH3= 0,4 mol, nCuO =0,5 mol
Do nên hiệu suất tính theo NH3
Đặt số mol NH3 phản ứng là x mol
2NH3+ 3CuO N2+ 3Cu + 3H2O
x 1,5x 1,5x mol
Chất rắn X có chứa 0,5-1,5x mol CuO dư và 1,5xmol Cu
nHCl ban đầu= 0,8mol
CuO + 2HCl→ CuCl2+ H2O
Số mol HCl giảm đi một nửa → nHCl pứ= 0,8/2=0,4 mol
Theo PT: nHCl pứ= 2.nCuO= 2.(0,5-1,5x)=0,4
→ x= 0,2 mol
H = n N H 3 p u n N H 3 b d . 100 % = 0 , 2 0 , 4 . 100 % = 50 %
Đáp án A

Đáp án B
Khí CO khử được oxit kim loại sau nhôm
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
Vậy hỗn hợp rắn còn lại trong ống sứ gồm Al2O3, Cu, Fe, MgO

CO khử được oxit của các kim loại đứng sau Al tạo thành kim loại tương ứng và giải phóng khí CO2.
Đáp án B

Đáp án A
CO hay H2 cũng lấy đi [O] trong oxit theo tỉ lệ 1 : 1.
{CO; H2} + [O] → {CO2; H2O} ⇒ nX phản ứng = nO phản ứng.
Bảo toàn khối lượng: mO phản ứng = 36,1 – 28,1 = 8(g).
nX phản ứng = 0,5 mol ⇒ VX phản ứng = 11,2 lít

Đáp án D
Gọi số mol CuO là x, Al2O3 là y mol
Ta có
CuO + CO → Cu + CO2
x mol x mol
Al2O3+ CO → không phản ứng
Ta có: 80x +102y= 9,1
mchất rắn sau pứ= mCu + mAl2O3= 64x+ 102 y=8,3 gam
Giải hệ trên ta có x= 0,05;y= 0,05 →mCuO= 4 gam

Chọn C
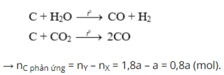
Theo bài ra có khối lượng chất rắn giảm chính bằng khối lượng O bị lấy ra khỏi oxit.
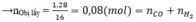
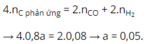
Bảo toàn electron:
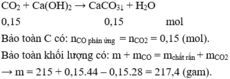

Ta có: nCuO (ban đầu) = 8/80 = 0,1 (mol)
Cách 1: PT: \(CuO+CO\underrightarrow{t^o}Cu+CO_2\)
Giả sử: \(n_{CuO\left(pư\right)}=x\left(mol\right)\)
⇒ mCuO (pư) = 80x (g) ⇒ mCuO (dư) = 8 - 80x (g)
Theo PT: \(n_{Cu}=n_{CuO\left(pư\right)}=x\left(mol\right)\)
Chất rắn thu được sau pư gồm: CuO dư và Cu.
⇒ mcr = mCuO (dư) + mCu
⇒ 6,72 = 8 - 80x + 64x
⇒ x = 0,08 (mol)
\(\Rightarrow H\%=\dfrac{0,08}{0,1}.100\%=80\%\)
Cách 2:
Giả sử: nCuO (pư) = x (mol)
Bản chất pư: CO + O → CO2
________________x (mol)
Ta có: mgiảm = mO ⇔ 8 - 6,72 = 16x ⇒ x = 0,08 (mol)
⇒\(H\%=\dfrac{0,08}{0,1}.100\%=80\%\)
Bạn tham khảo nhé!