Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trích mẫu thử
Sục hỗn hợp vào dung dịch NaOH :
- mẫu thử nào mất màu vàng nhạt là Clo
\(2NaOH + Cl_2 \to NaCl + NaClO + H_2O\)
Nung nóng các mẫu thử còn lại với Ag ở nhiệt độ cao :
- mẫu thử nào làm chất rắn chuyển sang màu đen là ozon
\(2Ag + O_3 \xrightarrow{t^o} Ag_2O + O_2\)
- mẫu thử không hiện tượng : oxi

Dùng que đóm còn than hồng để nhận biết O2. Còn lại hai bình là H2S và SO2 mang đốt, khí nào cháy được là H2S, khí không cháy là SO2.
2H2S + 3O2 -> 2H2O + 2SO2.

Cách 1: Cho hỗn hợp khí đi qua dung dịch HBr hoặc dung dịch HI, Cl 2 sẽ oxi hoá HBr hoặc HI thành Br 2 hoặc I 2 làm cho dung dịch không màu ban đầu chuyển thành màu vàng hoặc màu nâu.
Cl 2 + 2HBr → 2HCl + Br 2 (dung dịch có màu vàng)
hoặc Cl 2 + 2HI → 2HCl + I 2 (dung dịch có màu vàng nâu)
Cách 2: Có thể nhận ra Cl 2 có trong hỗn hợp khí bằng quỳ tím ấm.
Khi cho quỳ tím ẩm vào bình khí nếu quỳ tím ẩm chuyển sang màu đỏ sau đó mất màu đỏ chứng tỏ trong hỗn hợp khí có Cl 2

Cho hỗn hợp khí đi qua ống đựng bột đồng kim loại đun nóng, khí Cl 2 tác dụng với đồng kim loại tạo muối clorua là chất rắn. Chất khí không tác dụng với đồng kim loại là HCl, nên chất khí đi ra chỉ là HCl.
Cu + Cl 2 → t ° Cu Cl 2

Dẫn từng khí đó đi qua nước clo có pha sẵn hồ tinh bột, chất nào tạo ra chất mới có màu xanh là HI.
Cl 2 + HI → 2HCl + I 2

Đặt x và y lần lượt là số mol O3 và O2 trong hỗn hợp
2O3 → 3O2
Trước phản ứng : (x + y) mol hỗn hợp
Sau phản ứng: 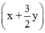 mol
mol
Số mol tăng là: 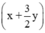 - (x + y) = 0,5y.
- (x + y) = 0,5y.

Đặt x và y lần lượt là số mol của O2 và O3 trong hỗn hợp
2O3 -> 3O2
y 1,5y
Trước phản ứng (x + y) mol hỗn hợp.
Sau phản ứng (x + 1,5y) mol.
Số mol tăng là (x + 1,5y) – (x + y) = 0,5y.
b) 0,5y tương ứng với 2% => y tương ứng với 4%.
Vậy thành phần phần trăm khí oxi là 96% và ozon là 4%.
+ Dùng giấy quỳ tím tẩm nước để nhận ra khí HCl.
+ Dùng nước vôi trong để nhận ra khí CO 2
+ Dùng dung dịch chứa hỗn hợp KI và hồ tinh bột để nhận ra ozon.
+ Khí còn lại là oxi.